مطالب مرتبط:
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- راهنمای کامل الکتروفورز آگارز + تصویری | بیوتکنولوژی
- رفع اشکال کامل و تخصصی الکتروفورز DNA | ژل اگارز| بیوتکنولوژی
- تئوری و مبانی کامل ژل الکتروفورز +تصویری | بیوتکنولوژی
- اصول تکنیک الکتروفورز DGGE (ژل الکتروفورز با گرادیان شیب ماده دناتوره کننده)
- تکنیک الکتروفورز دو بعدی | بیوتکنولوژی
- الکتروفورز پروتئین سرم(SPEP) | روش اجرا | و شرح کامل اجزای سرم پروتئین
- ایزوالکتروفوکوسینگ | IEF | بیوتکنولوژی | الکتروفورز با نقطه ایزوالکتریک
تکنیک ایزوالکتروفوکوسینگ
تکنیک ایزوالکتروفوکوسینگ یا الکتروفوکوسینگ جهت جداسازی انواع مولکول ها با استفاده از نقطه ایزوالکتریک مورد استفاده قرار میگیرد. این تکنیک نوعی الکتروفورز ناحیه ای می باشد که بر روی پروتئین های موجود در ژل صورت می گیرد. اساس این تکنیک بهره جستن از عملکرد بار کلی مولکولی به عنوان تابعی از PH محیط اطراف می باشد.
IPG IEF
تکنیک IEF شامل افزودن محلول آمفولیت ها به ژل های دارای شیب PH تثبیت شده (IPGs) است. IPGها ماتریکس آکریل امید پلیمریزه شده با شیب PH می باشد که منتج به ایجاد شیب های کاملا پایدار می شود البته به جز در PHهای با شدت قلیایی بالا. شیب PHبدست امده با تغییر یکنواخت در شیب غلظتی تثبیت شونده ها شیب PHی ایجاد میکند. تثبیت شونده نوعی اسید ضعیف یا باز ضعیف است که با میزان PK آن تعریف می شود.
پروتئینی که در PH کمتر از نقطه ایزوالکتریک خود می باشد دارای بار مثبت می باشد و از این رو به سمت کاتد حرکت خواهد نمود. هنگامی که در یک شیب افزایشی PH مهاجرت می کند بار کلی پروتئین کاهش خواهد یافت تا اینکه در ناحیه ایزوالکتریک بار خالص آن صفر خواهد شد. در این موقع پروتئین بدلیل نبود بار در میدان متوقف خواهد شد. در نتیجه این اتفاق پروتئین در یک نقطه تشکیل باند شارپ می دهد. در واقع PI هر پروتئین مانند اثر انگشت آن می باشد و هر پروتئین در نقطه ایزوالکتریک تشکیل باند خواهد داد.
این تکنیک بیشتر در مطالعات پروتئین ها به کار برده می شود که بر اساس محتوای آمینواسیدی آنها به جداسازی انها می پردازد. پروتئین ها در یک شیب تثبیت شده PH شامل پلی اکریل آمید، نشاسته و یا آگارز قرار می گیرند. معمولا در این پروسه ژل های با اندازه منافذ بزرگ مورد استفاده قرار می گیرند تا اثر غربالگری و دیگر اثرات کاذب حذف گردد. این تکنیک قادر به جداسازی پروتئین هایی با تفوت PI/ 0.01 می باشد. تکنیک ایزوالکتروفوکوسینگ اولین گام در الکتروفورز دوبعدی می باشد که پروتئین ها در آن ابتدا بر حسب PI جدا می شوند و سپس با استفاده از تکنیک SDS-PAGE بر اساس وزن جدا می شوند.
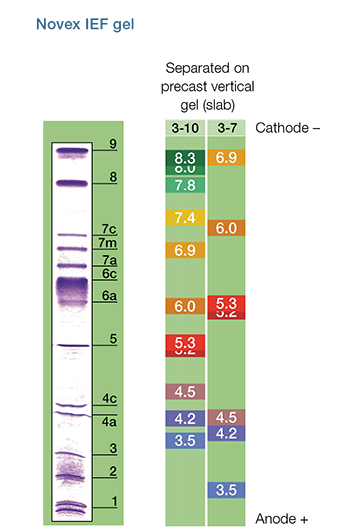
شکل 1) در ایزوالکتروفوکوسینگ مخلوط پروتئینی بر حسب مقدار PI خود و بدون در نظر گرفتن اندازه، در یک شیب PHی بین 3 تا 10 بر روی نوار IPG جدا می شود.
ایزوالکتروفوکوسینگ در ژل پلی اکریل آمید لوله ای
IEF لوله ای از اشکال ساده و ابتدایی این تکنیک می باشند. انجام IEF در حال حاضر در بخش قابل توجهی از مراکز تحقیقاتی و تشخیصی متداول می باشد. این روش بطور معمول در ژل پلی اکریل امید با غلظت 3-5 درصد و قطر 1-2 میلی متر وصرت می گیرد. IEF در تانک تیوب ژل را می توان به اهداف مختلفی همچون بررسی اجزای نمونه های پروتئینی، میزان خلوص، تعیین نقاط ایزوالکتریک و برخی اهداف تشخیصی به کار برد. در روش الکتروفورز دو بعدی که به روش اوفارل انجام میگیرد ایزوالکتروفوکوسینگ به عنوا بعد اول در تانک تیوب ژل وصرت می گیرد. از آنجایی که نمونه های پروتئینی در بسیاری از موارد شامل نمونه سلول یا بافت است، می توان IEF را در شرایط دناتوره گننده انجام داد تا امکان تفکیک مطلوب تری فراهم آید. در اینجا IEF در تانگ تیوب ژل در شرایط دناتوره شونده توضیح داده خواهد شد.
مواد
- محلول استوک اکریل آمید. 29.1 گرم اکریل آمید مخصوص IEF و 0.9 گرم بیس اکریل امید را در زیر هود وزن کنیدو در آب مقطر تا حجم نهایی 100 میلی لیتر حل نمایید. در صورت نیاز محلول را با کاغذ واتمن شماره 1 صاف کنید. این محلول در ظرف تیره در یخچال تا 3 هفته قابل استفاده می باشد. درصد T و C این محلول (به عنوان استوک) به ترتیب 30 و 3 درصد می باشد.
- آمفولیت. آمفولیت، فارمالیت یا مخلوطی از آن دو در دامنه PH 5-10 .
- اوره با درجه خلوص بالا.
- دترجنت NP-40 (محلول استوک 20 درصد) یا چیپس (CHAPS).
- پرسولفات آمونیوم 10 درصد. 0.1 گرم پر سولفات آمونیوم را در 1 میلی لیتر آب مقطر حل کنید (این محلول باید تازه باشد).
- TEMED 10 درصد. 0.1 میلی لیتر TEMED را در 0.9 میلی لیتر آب مقطر حل کنید(این محلول باید تازه باشد).
- بافر نمونه( بافر تریس- HCL02 مولار با PH/ 7.5 حاوی اوره 9 مولار، NP-40 4 درصد و آمفولیت 4 درصد). 5.4 گرم اوره ، 2 میلی لیتر NP-40 و 0.4 میلی لیتر آمفولین را در بافر تریس تا حجم نهایی 10 میلی لیتر حل نمایید. چند کریستال برموفنل بلو اضافه کنید تا محلول به رنگ آبی در آید.
- اتیلن گلایکل با درجه خلوص بالا.
- بافر پوشاننده. همان بافر نمونه است که دوبار با آب مقطر رقیق شده است.
- آنولیت. شامل اسید فسفریک 0.01 مولار است.
- کاتولیت. شامل محلول هیدروکسید سدیم 0.01 مولار است.
- مارکرهای PI
روش آزمایش
- لوله های تانک تیوب ژل را کاملا تمیز و خشک کنید. ته آنها را کاملا با پارافیلم ببنیدید و در جاله له ای به طور عمودی قرار دهید. برای تهیه 10 میلی لیتر محلول ژل با غلظت 4.2 ٪، 1.4 میلی لیتر محلول استوک اکریل آمید، 5 گرم اوره، 0.6 میلی لیتر امفولین، 0.75 میلی لیتر اتیلن گلایکول، 0.05 میلی لیتر TEMED 10 درصد و بقیه (تا حجم 9.5 میلی لیتر) را آب مقطر بریزید و به هم زنید تا حل شود. محلول را برای چند دقیقه از هوا تخلیه کنید. سپس 0.5 میلی لیتر دترجنت NP-40 و 0.03 میلی لیتر پر سولفات آمونیوم اضافه کنید.
- محلول ژل را به دورن یک سرنگ بکشید. سر سرنگ را وارد هر لوله نمایید و تا 2 سانتیمتر مانده به ابتدای ان از محلول ژل پر کنید.انعقاد ژل حدود 1 ساعت طول می کشد. پس از انعقا ژل ، ته هر لوله را باز کنید و آن را در محل مربوطه در دستگاه الکتروفورز تیوب ژل قرار دهید. مقداری بافر کاتدی (کاتولیت) را در مخزن بالا بریزید و در صورت اطمینان از عدم نشت مایع از کنار لوله ها، ابتدا مخزن پایین را با آنولیت تا ارتفاع مناسب پر کنید. پر کردن لوله های باریک با چنین روشی مشکل است. برای پر کردن لوله های باریک، آنها را روی یک سطح افقی قرار دهید و با سرنگ از یک طرف پر کنید. در این حالت نیازی به بستن انتهای لوله ها نیست.
سپس مقدار دیگری کاتولیت به مخزن بالا اضافه کنید. به طوری که سطح مایع بالاتر از لوله ها قرار گیرد.
- دمای آب گردشی را روی 15 درجه سانتیگراد تنظیم کنید (حداقل 10 دقیقه قبل). مرحله پیش فوکوسینگ را به مدت 20-30 دقیقه با شدت جریان 1 میلی آمپر به ازای هر لوله انجام دهید. سپس جریان برق را قطع کرده، نمونه گذاری نمایید. برای نمونه گذاری یک حجم نمونه پروتئین را با 2-3 حجم بافر نمونه مخلوط کنید. سپس 10-40 میکرولیتر (بسته به قطر لوله ها) از آن را با سرنگ هامیلتون یا سمپلر با دقت به سطح ژل هر نمونه اضافه کنید. پس از نمونه گذاری، 10 میکرولیتر بافر پوشاننده (بافر نمونه که 2 بار با آب مقطر رقیق شده است) به آرامی روی نمونه ها اضافه کنید.
- عمل الکتروفوکوسینگ را به مدت 8-10 ساعت در 600 ولت و 1 ساعت در 800 ولت (برای ژلی به طول 10 سانتیمتر) انجام دهید. پس از اتمام الکتروفورز، لوله ها را از دستگاه تیوب ژل خارج نمایید ، ژل درون آنها را به آرامی با فشار آب مقطر توسط سرنگ خارج نمایید. در صورت لزوم ژل را رنگ آمیزی کنید.
فیلم آموزش انجام تکنیک ایزوالکتروفوکوسینگ یا الکتروفوکوسینگ (زبان انگلیسی)
فیلم آموزش تئوری تکنیک ایزوالکتروفوکوسینگ یا الکتروفوکوسینگ (زبان انگلیسی)
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب مشابه :
- اصول PCR و کاربردهای آن، طراحی پرایمر
- دستگاه فرمانتور | بیوراکتور چیست؟
- کامل ترین مجموعه کروماتوگرافی |انواع و روشهای کروماتوگرافی| بیوتکنولوژی
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
- معرفی تجهيزات آزمايشگاهی
- رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامه ها
- رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- آموزش RSM| تحلیل نمودارهای آماری در روش سطح پاسخ | نرم افزار دیزاین اکسپرت