مطالب مرتبط:
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- راهنمای کامل الکتروفورز آگارز + تصویری | بیوتکنولوژی
- رفع اشکال کامل و تخصصی الکتروفورز DNA | ژل اگارز| بیوتکنولوژی
- تئوری و مبانی کامل ژل الکتروفورز +تصویری | بیوتکنولوژی
- اصول تکنیک الکتروفورز DGGE (ژل الکتروفورز با گرادیان شیب ماده دناتوره کننده)
- تکنیک الکتروفورز دو بعدی | بیوتکنولوژی
- الکتروفورز پروتئین سرم(SPEP) | روش اجرا | و شرح کامل اجزای سرم پروتئین
- ایزوالکتروفوکوسینگ | IEF | بیوتکنولوژی | الکتروفورز با نقطه ایزوالکتریک
راهنمای کامل الکتروفورز آگارز
الکتروفورز آگارز نوعی از ژل الکتروفورز میباشد که در زمینه های بیوشیمی ، ژنتیک و دیگر زیر گروه های علوم سلولی و مولکولی جهت جداسازی انواع توالی DNA ، RNA و یا پروتئین در یک بستر ایجاد شده با استفاده از ژل آگارز مورد استفاده قرار می گیرد. همانگونه که در فایل های قبل ذکر شد ، جداسازی مولکولهای زیستی با اعمال نمودن یک میدان الکتریکی بر روی این بستر رخ می دهد. ژل های آگارز به راحتی قابل شکل گیری می باشند و مهمترین گزینه جهت جداسازی انواع مختلف DNA در آزمایشگاه می باشند. DNA جدا سازی شده را می توان با رنگ آمیزی زیر نور UV مشاهده نمود.
ویژگی های ژل آگارز
ژل آگارز نوعی ماتریکس سه بعدی تشکیل شده از مولکول های هلیکسی آگارز می باشد که کنار هم قرار گرفتن به صورت سه بعدی منافذی ایجاد می نمایند که جهت جداسازی بیو مولکول ها فوق العاده مناسب می باشند. تمام این ساختار سه بعدی تشکیل شده حاصل پیوند های هیدروژنی می باشد که میتوان با افزایش درجه حرارت آن را از بین برد. دمای ژله ای شدن آگارز بسیار متفاوت از دمای ذوب آن می باشد. بسته به نوع منبع، آگارز دارای دمای ژله ای شدن بین 35-42 درجه سانتیگراد می باشد و دمای ذوب آن حدود 85-95 درجه سانتیگراد می باشد. ژل آگارز به دلیل اندازه بزرگ منافذ و قدرت ژل بالای آن برای الکتروفورز پروتئین های بزرگ و نیز DNA بسیار مناسب می باشد. ژل آگارز 1 ٪ دارای منافذ در حدود 100 تا 300 نانو متر می باشد. غلظت های پایین ژل بسیار ظریف می باشند و جابجایی آنها خیلی مشکل دارد. ژل آگارز به دلیل اندازه بزرگ منافذ، قدرت جداسازی و تفکیک پایین تری نسبت به اکریل آمید برای DNA دارد، اما دامنه جداسازی آن بسیار وسیعتر می باشد. حداکثر بازه جداسازی توسط این نوع ژل حدود 750 کیلو باز می باشد، اما برای جداسازی های در حد 6 مگا باز از تکنیک PFGE استفاده می شود. این تکنیک همچین برای جداسازی پروتئین های بزرگ نیز کاربرد دارد و میتواند با کارآیی بالایی ذرات دارای شعاع موثر بیشتر از 5-10 نانومتر را جدا سازد. یک ژل آگارز 0.9 ٪ آنقدر بزرگ میباشد که باکتریوفاژ T4 بتواند وارد آن شود.
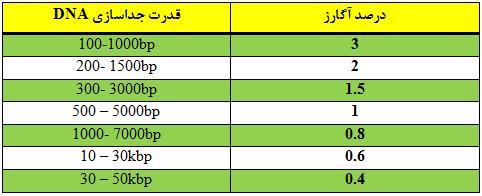
شکل 1) غلظت های مختلف آگارز جهت جداسازی قطعات DNA با اندازه های متفاوت
پلی مر آگارز دارای یکسری بارهای منفی بر روی گروه های باردار پیرووات و سولفات می باشد. این گروه های با بار منفی طی فرایندی به نام الکترواندو اسموزیس (EEO)موجب حرکت جریان آب به سمت مخالفت حرکت DNA میگردند. همین امر موجب ایجاد تاخیر در حرکت مولکول DNA و متعاقبا جداسازی آن میگردد که موجب ضعیف شدن باندهای تشکیل شده میگردد.
فاکتورهای تاثیرگذار بر مهاجرت اسیدهای نوکلئیک در ژل
فاکتورهای زیادی می توانند مهاجرت اسیدهای نوکلئیک را تحت تاثیر قرار دهند: اندازه های منافذ ژل (غلظت ژل)، اندازه قطعات DNA ، ولتاژ اعمال شده، قدرت یونی بافر، و غلظت رنگ intercalate شونده (مانند اتیدیوم برماید) درصورتی که در طی الکتروفورز افزوده شود. مولکول های کوچک تر سریعتر از مولکول های بزرگتر در ژل حرکت می کنند و DNA دو رشته ای با نرخ 1/LOG تعداد بازها در ژل حرکت می کند. اما این رابطه برای توالی های با طول بسیار بلند صادق نمی باشد. افزایش غلظت ژل موجب کاهش سرعت حرکت DNA بر روی ژل می شود.
از طرف دیگر کنفورماسیون DNA می تواند حرکت آن را بر روی ژل تحت تاثیر قرار دهد. به عنوان مثال DNA سوپر کویل شده دارای حرکتی سریعتر از DNA ریلکس میباشد، زیرا DNA سوپرکویل شده فشرده تر می باشد و از این رو راحت تر بر روی ژل حرکت می کند. ژل الکتروفورز مولکول های پلاسمیدی نشان دهنده حالت سوپر کویل منفی می باشد. اما مولکول DNA حلقوی باز (Nicked) و فرم های ریلکس حلقوی به صورت باندهای کوچکتر ظاهر می شوند.
اتییدیوم برماید که می تواند بین دو رشته DNA قرار بگیرد، می تواند بار، طول و نیز حالت سوپرکویل مولکول DNA را تحت تاثیر قرار دهد و بنابراین حضور آن در ژل در هنگام عمل الکتروفورز حرکت DNA را تحت تاثیر قرار می دهد. ژل الکتروفورز آگارز میتواند جهت جداسازی انواع DNA حلقوی با توپولوژی سوپرکویلینگ مختلف نیز مورد استفاده قرار بگیرد.
مهاجرت غیرطبیعی
ژل خندان (smily gel): این حالت زمانی رخ می دهد که ولتاژ اعمال شده برای غلظت های ژل مورد استفاده خیلی زیاد باشد.
بیش از اندازه DNA ریختن: این امر موجب حرکت کند قطعات DNA خواهد شد.
کثیف شدن ژل: وجود ناخالصی هایی مانند نمک ها و یا پروتئین ها می تواند حرکت DNA را تحت تاثیر قرار دهد.
مکانیسم مهاجرت DNA و جداسازی آن
بار منفی چارچوبه های فسفاتی مولکول DNA را به سمت آند دارای قطب مثبت حرکت می دهد. باید در نظر گرفته شود که در عدم حضور ماتریکس ژلی مهاجرت مولکول DNA مستقل از وزن مولکولی و اندازه آن می باشد. پس میتوان گفت نقش ماتریکس ژلی جداسازی DNA بر اساس اندازه طی عمل الکتروفورز می باشد.
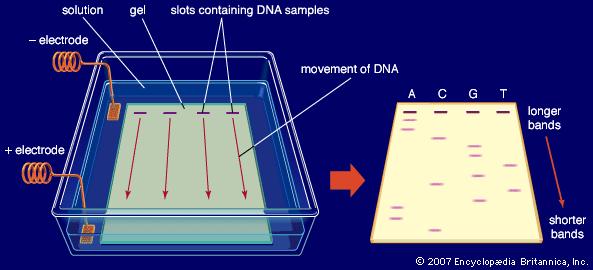
شکل 2) شمای کلی عمل الکتروفورز و جهت حرکت اسیدهای نوکلئیک
تهیه ژل
ژل آگارز را میتوان با حل نمودن پودر آگارز در بافر مناسب (مانند TAE یا TBE) بدست آورد. پودر آگارز ابتدا در بافر مورد نظر حل میشود و سپس تا نزدیک دمای جوش گرم می شود، اما باید دقت کرد که نجوشد. آگارز ذوب شده را قبل از ریختن در ژل تری به خوبی سرد نموده. اگر دمای آن بسیار بالا باشد، ممکن است تری ژل سوراخ شود.
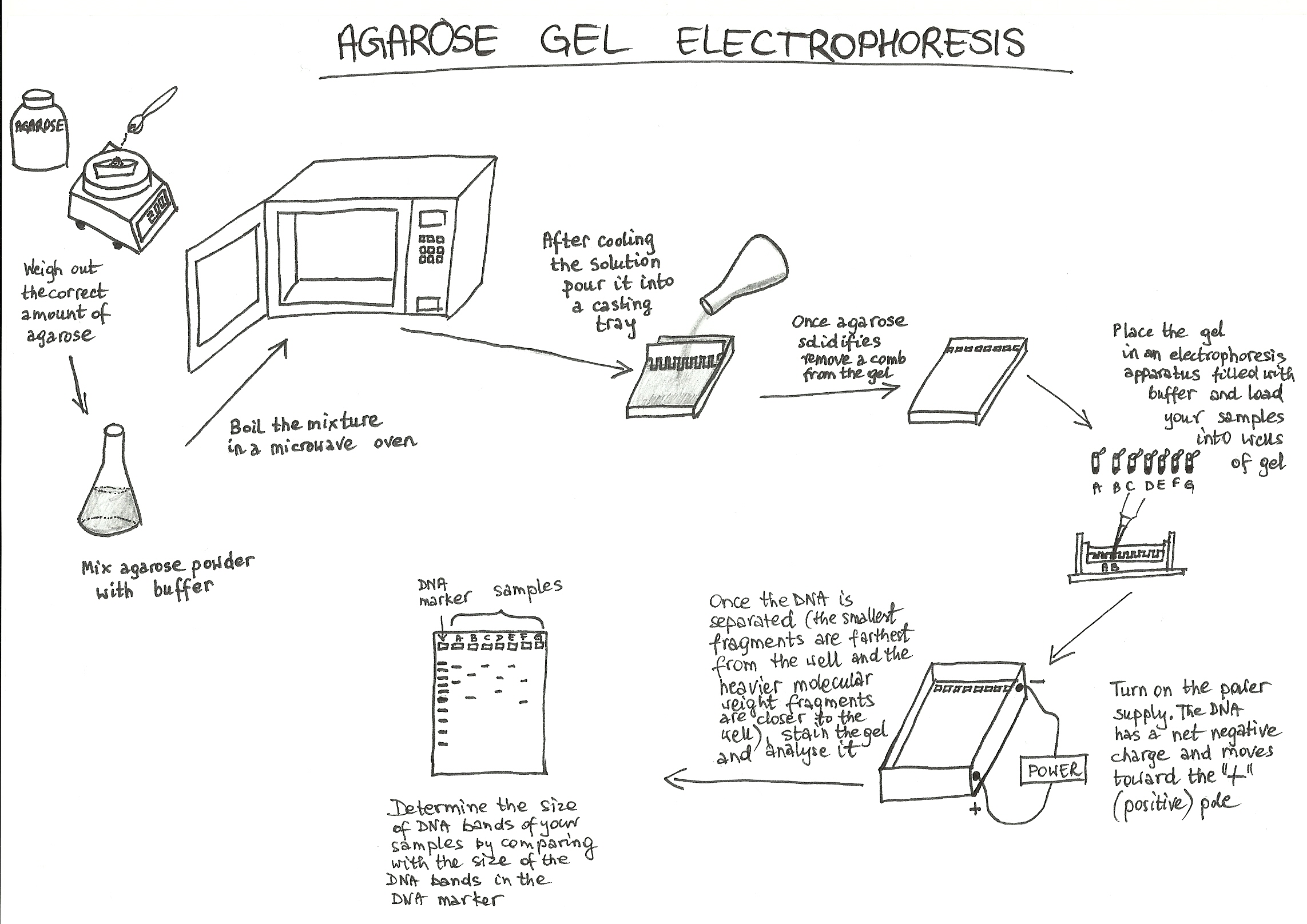
شکل 3) شماتیک مراحل تهیه ژل آگارز
شانه را قبل از ریختن آگارز ذوب شده در تری قرار داده تا به خوبی چاهک های مخصوص بارگیری نمونه تشکیل شوند. غلظت ژل 1 ٪ معمولا برای یک عمل الکتروفورز روتین تهیه می شود.
بارگیری نمونه ها
هنگامی که ژل بسته شد، شانه را از آن بیرون آورده و حالا میتوان با قرار دادن آن در محفظه تانک و ریختن بافر تازه به اندازه کافی نمونه ها را بارگذاری کرد. باید دقت کرد که قبل از بارگذاری نمونهها، آنها را با بافر Loading مخلوط نمود تا به راحتی در چاهک ها قرار بگیرند. معمولا بافر loading از یک ترکیب با چگالی بالا مانند گلیسرول، ساکاروز و یا فیکول می باشد که چگالی کلی نمونه ها را بالا می برد و نمونه DNA به راحتی در ته چاهک قرار خواهد گرفت. بافر Loading همچنین شامل رنگهایی مانند زایلن سیانول و بروموفنول بلو می باشد. این رنگ ها به منظور نشان دادن میزان پیشرفت نمونه ها بر روی ژل مورد استفاده قرار می گیرند. حالا نمونه های DNA را با استفاده از پیپت بارگذاری کنید.
شروع عمل الکتروفورز
ژل الکتروفورز آگارز معمولا در تانک الکتروفورز افقی ران می شود و در حین عمل الکتروفورز ژل کاملا در بافر غوطه ور می شود. همچنین میتوان این نوع الکتروفورز با به صورت عمودی انجام داد، اما کمتر از این نوع روش جهت الکتروفورز آگارز استفاده می شود.
باید دقت شود که ولتاژ بالاتر موجب جداسازی سریعتر نمونه ها خواهد شد، اما موجب ذوب شدن ژل و نیز بافر گردد و از این رو جداسازی نمونه ها با کیفیت خوبی صورت نگیرد. ولتاژ پایین نیز میتواند موجب پهن شدن باندها برای قطعات کوچک DNA شود. به دلیل آنکه مولکول DNA در نور معمولی قابل مشاهده نمی باشد ، همراه آنها رنگهایی نیز بارگذاری میگردد. زایلن سیانول (آبی کم رنگ) به همراه مولکول های بزرگ DNA مهاجرت می کند ، اما بروموفنل بلو (آبی تیره) همراه با با قطعات کوچک تر DNA مهاجرت می کند.
همچنین طی بارگزاری نمونه ها یک مارکر DNA نیز در چاهک جداگانه ای افزوده می شود. این مارکر حاوی قطعاتی از مولکول DNA با وزن های مشخص می باشد که برای تخمین وزن مولکول های DNA مورد استفاده قرار می گیرد. باید در نظر گرفته شود که حرکت مولکول های حلقوی DNA (مانند پلاسمید) متفاوت از حرکت مولکولهای خطی DNA می باشد و نمی توان با مارکر های معمول به تخمین وزن آنها پرداخت. از این رو لازم است قبل از ران نمودن آنها بر روی ژل با استفاده از آنزیمهای محدود الاثر آنها را به صورت خطی در آورد.
رنگ آمیزی و مشاهده
مولکول های DNA و RNA به طور معمول با استفاده از اتیدیوم برماید رنگ آمیزی می شوند. این رنگ با قرار گرفتن در شیار بزرگ DNA میتواند زیر نور UV فلوئورسانس ساتع نماید و با استفاده از دستگاه ژل داک مشاهده گردد. اتیدیوم برماید را میتوان قبل از بسته شدن ژل آگارز اضافه نمود و یا میتوان بعد از عمل الکتروفورز به نمونه ها افزود. رنگ های دیگری که میتوان از آنها برای رنگ آمیزی استفاده نمود عبارتند از: سایبرگرین، ژل رد، متیلن بلو، بریلیان کریستال بلو، کریستال ویولت. معمولا رنگهای سایبرگرین، ژل رد و دیگر محصولات تجاری مشابه به عنوان جایگزینهای سالمتر از اتیدیوم برماید مورد استفاده قرار میگیرند. تست آمز قابلیت موتاژنیک (جهش زایی) را نشان می دهد. جهت مشاهده نمونه ها با استفاده از سایبرگرین لازم است که از ترانسلومیناتور با رنگ آبی استفاده گردد. DNA رنگ آمیزی شده با استفاده از کریستال ویوله قابلیت مشاهده در نور معمولی را دارد که نیازی به استفاده از ترانسلومیناتور ندارد، اما این نور زیاد قوی نمی باشد. معمولا ترانسلومیناتورهای معمول از طول موج های 302 و 312 نانومتر (UV-B) استفاده می کنند. اما باید این نکته را در نظر گرفت که تابش نور UV به مدت 45 ثانیه میتواند موجب صدمه به DNA بشود و از این رو فرایندهای بعدی که DNA لازم است (مانند PCR و ترانسفورماسیون) کارایی کمتری پیدا کنند. استفاده از دستگاه های UV با طول موج بلندتر 365 نانومتر (دامنه UV-A) موجب صدمه کمتر به DNA میشود ، اما موجب نشر بسیار ضعیفتر فلوئورسانس با اتیدیوم برماید خواهد شد. از این رو بهتر است با هر دو طول موج کار شود:از طول موج های کوتاهتر برای تصویربرداری از ژل استفاده شود و از طول موج های بلندتر برای مشاهده ژل و هر گونه عمل دیگر بر روی ژل که نیازمند زمان طولانی تر می باشد استفاده شود.
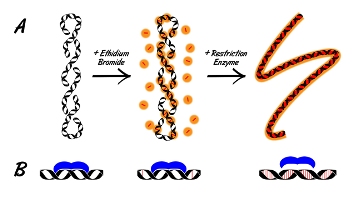
شکل 4) مکانیسم قرار گیری اتیدیوم برماید بین دو رشته DNA . شکل a نشان دهنده ساختار اتیدیوم برماید می باشد.
بافرها
در واقع بار خالص ماکرومولکول های زیستی بسیار وابسته به pH محیط می باشد. به منظور کاهش تغییرات pHی ایجاد شده در اثر میدان الکتریکی، عمل الکتروفورز در محیط بافری صورت می گیرد. به طور معمول بافر ایده ال باید دارای هدایت پذیری بالا باشد و همچنین گرمای کمتری تولید کند و زمان ابقا طولانی داشته باشد. تعدادی از بافرها که برای الکتروفورز آگارز جهت جداسازی اسیدهای نوکلئیک استفاده میشوند عبارتند از: تریس استات EDTA (TAE) و تریس بورات EDTA (TBE) . بافرهای دیگری نیز مورد استفاده قرار می گیرند که نسبت به دو بافر ذکر شده کاربری بسیار کمتری دارند. بافر تریس دارای ظرفیت بافری بالایی می باشد اما در صورتی که DNA استخراج شده در واکنش حساس با فسفات مورد استفاده قرار می گیرد، نمی توان از آن استفاده کرد. بافر TAE دارای کمترین ظرفیت بافری می باشد اما قدرت تفکیک آن برای مولکول های بزرگ DNA بسیار خوب می باشد. معمولا بافرهایی که حاوی EDTA هستند، جهت غیر فعالسازی انواع نوکلئازهایی که نیازمند کاتیون های دوظرفیتی جهت فعالیت خود می باشند، استفاده می کنند. در صورتی که باید جداسازی در حد جفت باز صورت گیرد، باید از ژل با 3 ٪ آگارز و نیز محیط با هدایت پذیری فوق العاده پایین که توسط بافر 1 میلی مولار لیتیوم بورات ایجاد میگردد، استفاده شود. در صورت استفاده از بافرها برای مدت طولانی، ظرفیت بافری آنها کم خواهد شد و شاید نتواند دیگر محیط لازم جهت انجام عمل الکتروفورز را فراهم آورد.
کاربردها
- تخمین اندازه مولکول های DNA بعد از برش با انزیم های محدودالاثر:به عنوان مثال نقشه یابی DNA کلون شده بعد از در معرض آنزیم های محدود الاثر قرار گرفتن.
- آنالیز محصولات PCR :به عنوان مثال استفاده در تشخیص ژنتیک و یا Genetic fingerprinting
- جداسازی قطعات DNA برای استخراج و تخلیص
- جداسازی DNA ژنومی بریده شده قبل از انتقال ساترن و یا برای RNA قبل از انتقال نوردرن (Northern blotting).
ژل های آگارز به راحتی قابل شکل گیری و جابجایی هستند و همچنین اسیدهای نوکلئیک هیچ گونه واکنش شیمیایی با آنها انجام نمی دهند. نمونه ها در آن به راحتی قابل جستجو هستند. بعد از اتمام آزمایش، ژل بدست آمده را میتوان در یک نایلون قرار داد و در یخچال نگهداری کرد.
فیلم آموزش الکتروفورز DNA تولید شده در فرایند PC | ژل آگارز (زبان انگلیسی)
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب مشابه :
- اصول PCR و کاربردهای آن، طراحی پرایمر
- دستگاه فرمانتور | بیوراکتور چیست؟
- کامل ترین مجموعه کروماتوگرافی |انواع و روشهای کروماتوگرافی| بیوتکنولوژی
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
- معرفی تجهيزات آزمايشگاهی
- رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامه ها
- رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- آموزش RSM| تحلیل نمودارهای آماری در روش سطح پاسخ | نرم افزار دیزاین اکسپرت

دیدگاهها
من یه سوال داشتم میخواستم بپرسم علت کفکردن ژل الکتروفورز چی میتونه باشه درصورتی که بافر خیلی کهنه نباشه
ممنون میشم راهنماییم بفرمایید
این حالت کاملا طبیعی است و بافر ها مشکلی ندارند.
ار باید در محدوده هزارو پانصد (مثلا برای یک باکتری خاص) باید باند بدهد اما از روی لدر که نگاه میکنید اندازه باند بین 100 تا 200 جفت باز است؟ مشکل کجای کار بوده؟. ممنون
چرا التروفورز پروتئین تحت امپر ثابت و الکتروفورزDNAتحت ولتاژ ثابت انجام میشه؟؟
اگر اندازه تانک تغییر کند نیاز هست در حین کار ولتاژ و زمان را نیز افزایش دهیم؟
میشه لطفا علت عمودی بودن الکنروفورز آکریل آمید و افقی بودن الکتروفورز آگارز و برام توضیح بدید