مطالب مرتبط:
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- راهنمای کامل الکتروفورز آگارز + تصویری | بیوتکنولوژی
- رفع اشکال کامل و تخصصی الکتروفورز DNA | ژل اگارز| بیوتکنولوژی
- تئوری و مبانی کامل ژل الکتروفورز +تصویری | بیوتکنولوژی
- اصول تکنیک الکتروفورز DGGE (ژل الکتروفورز با گرادیان شیب ماده دناتوره کننده)
- تکنیک الکتروفورز دو بعدی | بیوتکنولوژی
- الکتروفورز پروتئین سرم(SPEP) | روش اجرا | و شرح کامل اجزای سرم پروتئین
- ایزوالکتروفوکوسینگ | IEF | بیوتکنولوژی | الکتروفورز با نقطه ایزوالکتریک
تکنیک الکتروفورز دو بعدی
مقدمه
پروتئومیکس مطالعه در مقیاس گسترده پروتئین ها می باشد. پروتئین ها با دارا بودن انواع مختلف عملکردها اجزای اساسی سلول ها می باشند. در واقع اصطلاح پروتئومیکس در سال 1997 بعد از مطرح شدن ژنومیکس بوجود آمد. پروتئوم کلیه پروتئین های تولید شده و تغییر یافته توسط یک ارگانیسم می باشند. پروتئومیکس یک ناحیه بین رشته ای می باشد که از اطلاعات ژنتیکی پروژه ژنوم انسان استفاده های زیادی کرده است.
بعد از ژنومیکس و ترانسکریپتومیکس ، پروتئومیکس گام بعدی جهت مطالعه سیستم های بیولوژیک می باشد. در اینجا ژیچیدگی مطالعات بسیار بیشتر از ژنومیکس می باشد، زیرا ژنوم یک ارگانیسم پایدار و با ثبات می باشد. اما پروتئوم از یک سلول به سلول دیگر و حتی از یک زمان به زمان دیگر در یک سلول متفاوت می باشد. قبلا جهت بررسی پروتئوم از آنالیز RNA استفاده می شد، اما معملوم شد که این نمی تواند با محتویات پروتئینی موجود همبستگی داشته باشد. امروزه معلوم شده که همیشه mRNA به پروتئین ترجمه نمی شود و میزان ترجمه آن به پروتئین بسته به ژن رونویسی شده و نیز شرایط فیزیولوژیک آن سلول دارد. پروتئومیکس دقیق ترین تکنیک جهت بررسی میزان پروتئین موجود در سلول می باشد.
به منظور بررسی پروتئوم موجودات زنده لازم است که پروتئوم آنها ابتدا خالص گردند. در واقع اولین مطالعات بر روی پروتئین ها با ابداع ژل دو بعدی در سال 1975 ، بر روی پروتئوم باکتری اکلای توسط اوفارل صورت گرفت. در واقع ژل الکتروفورز دو بعدی جزو اصلی تکنیک پروتئومیکس می باشد. الکتروفورز دو بعدی نوعی ژل الکتروفورز می باشد که جهت آنالیز پروتئین ها به کار برده می شود. در این تکنیک مخلوط پروتئینی با استفاده از دو ویژگی در ژل دو بعدی جدا می شود.
اصول تکنیک الکتروفورز دو بعدی
در الکتروفورز دو بعدی ابتدا بعد اول ران می شود و سپس به صورت عمود بر بعد اول مولکولها در بعد دوم ران می شوند تا یک الکتروفورگرام در بعد دوم شکل بگیرد. در بعد اول الکتروفورز ، پروتئین ها بر اساس نقطه ایزوالکتریکشان به صورت خطی جدا می شوند. در بعد دوم ، مولکول ها با 90 درجه تفاوت نسبت به بعد اول بر اساس وزن مولکولی شان جدا میشوند. از انجایی که دو مولکول به احتمال بسیار بسیار پایین در این دو ویژگی (نقطه ایزوالکتریک و وزن مولکولی) مشابع می باشند، مولکول ها با کیفیت بسیار بالاتری در الکتروفورز دو بعدی نسبت به الکتروفورز 1 بعدی جدا می شوند.
بعد اول این تکنیک را تکینیک الکتروفورز تمرکز ایزوالکتریک (IEF) گویند. در این روش یک گرادیان PHی برای ژل ایجاد می شود و یک طرف ژل نسبت به طرف دیگر آن مثبت تر می باشد. بعد دوم این تکنیک شامل SDS-PAGE در سیستم بافری ناپیوسته می باشد که در آن پروتئین ها با توجه به تفاوت وزن مولکولی تفکیک می گردند.
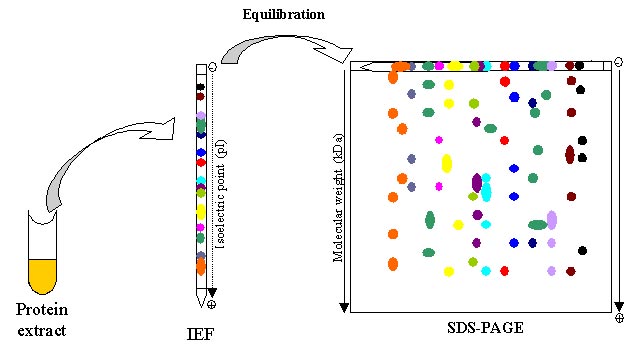
شکل 1) مراحل الکترروفورز دو بعدی
اگرچه الکتروفورز دو بعدی در ابتدا به هدف جداسازی تمام یا اکثر اجزای یک نمونه پروتئینی همچون عصاره سلول ها صورت گرفت، اما هر روزه کاربرد آن بیشتر می شود. مطالعه تنظیم بیان ژن ها و اثر شرایط مختلف بر تولید پروتئین ها در سلول، مقایسه فسفوریلاسیون پروتئین ها در سلول و حتی خالص سازی پروتئین ها به اهداف مختلف (مثل تعیین توالی اسیدهای آمینه) از دیگر موارد کاربرد این روش است.
آماده سازی نمونه
نتیجه مطلوب و جداسازی کامل اجزای نمونه در الکتروفورز دو بعدی تا حد زیادی وابسته به کارایی ایزوالکتریک فوکوسینگ می باشد که الکتروفورز بعد اول را تشکیل می دهد. در این روش بر خلاف SDS-PAGE نمی توان برای استخراج و یا محلول سازی نمونه، آن را در بافر حاوی سدیم دودسیل سولفات جوشاند. زیرا SDS با اتصال به پروتئین ها باعث تغییر در بار الکتریکی آنها می شود.
نمونه های پروتئین در IEF شامل مایعات بیولوژیک همچون سرم یا پلاسما، بافت های جانوری یا گیاهی و سوسپانسیون های سلولی همچون گلبول های خون و یا کشت سلول است. نمونه های مایع معمولا مشکل محلول سازی کمتری دارند و با تیمار ساده تری می توان آنها را الکتروفورز و تفیکیک نمود. بعضی از این محلول ها ، همانند سرم و پلاسما دارای غلظت بالایی از پروتئین هستند و قبل از استفاده باید رقیق گردند. محتوای بالای آلبومین و گاماگلوبولین سرم و پلاسما باعث می شود این پروتئین ها منقطه وسیعی را به خود اختصاص دهند و تعدادی از پروتئین های دیگر را بپوشانند.
برای آماده نمودن بافت های جامد بایستی آنها را در یک بافر مناسب هموژن کرد. سپس عصاره آنها را با کمک سانتریفیوژ با دور بالا صاف کرد. شرایط آماده سازی این بافت ها باید با حداقل تغییرات در پروتئین ها همراه باشد. برای هضم زمینه بافت و دسترسی ساده تر به پروتئین ها نمی توان این بافت ها را تحت تاثیر آنزیم های پروتئاز قرار داد. به منظور جلوگیری از فعالیت پروتئازها باید از مهارکننده هایی مانند PMSF استفاده کرد. در صورتی که غلظت اسیدهای نوکلئیک در نمونه بالا می باشد، می توان از آنزیم های نوکلئاز جهت هضم آنها استفاده کرد.
بافر حل کننده نمونه بایستی بتواند تمام پیوندهای غیر کوالان را در پروتئین های چند واحدی و تجمعات پروتئینی حذف نماید. این موضوع مخصوصا در مورد پروتئین های آب گریز که میل تجمع یافتن در آنها شدید است، اهمیت دارد. وجود این کمپلکس های پروتئینی مقاوم در نمونه ، باعث پیدایش نقاط جدیدی در الگوی الکتروفورزی می گردد که ممکن است تفسیر نتایج را مشکل کند. معمول ترین روش محلول سازی که ابتدا توسط اوفارل مطرح گردید، حل کردن نمونه در محلول حاوی دترجنت NP-40 4 درصد وزنی –حجمی ، اوره 9.5 مولار، آمفولیت 2 درصد و DTT یک درصد است. این روش در محلول نمودن بسیاری از نمونه های پروتئینی نتیجه خوبی دارد. با این حال نمی توان بعضی نمونه های پروتئینی را به طور کامل حل کرد. در بسیاری از موارد می توان به جای NP-40 از CHAPS که یک دترجنت آمفوتری است، برای حل نمودن پروتئین ها استفاده کرد. CHAPS جهت حل نمودن پروتئین های غشایی که آبگریز می باشند ارجهیت دارد. SDS نیز جهت حل کردن نمونه های پروتئینی مناسب است، اما به دلیل یونی بودن ، نمی توان از آن در IEF استفاده کرد. اگر در مواردی استفاده از SDS ضروری است، باید قبل از استفاده آن را با یک دترجنت بی بار مانند NP-40 رقیق یا جایگزین نمود.
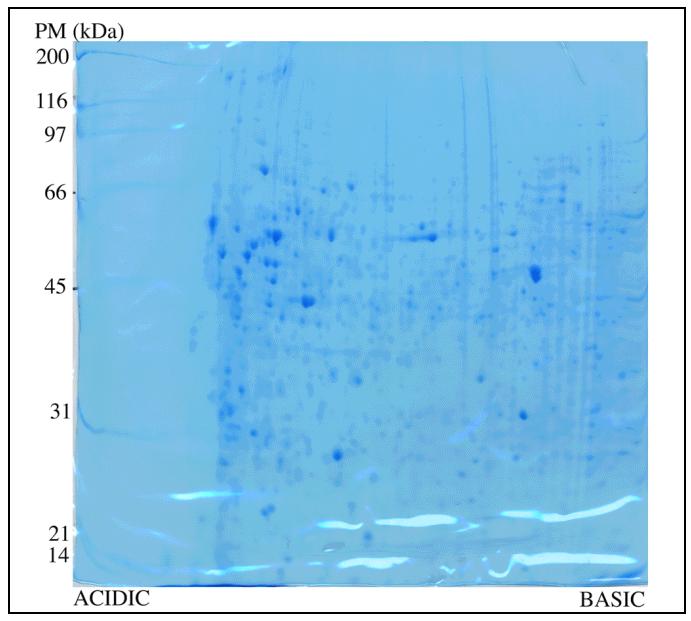
شکل 2) ژل الکتروفورز دو بعدی رنگ شده با کماسی بلو
الکتروفورز دوبعدی به روش اوفارل
همانگونه که قبلا توضیح داده شد روش اوفارل از متداول ترین روش های الکتروفورز دو بعدی است. در این روش، الکتروفورز در بعد اول IEF در تانک الکتروفورز تیوب ژل و در بعد دوم به روش SDS-PAGE است.
مراحل عملی تکنیک الکتروفورز دو بعدی با روش اوفارل به شرح زیر است:
- نمونه پروتئین را آماده کنید و به روش IEF در تانک تیوب ژل الکتروفورز نمایید. مواد و روش انجام الکتروفورز IEF در فایل مربوط به این تکنیک به طور کامل توضیح داده شده است.
- پس از اتمام IEF ، ژل درون لوله را با فشار آب مقطر خارج سازید، به نحوی که دچار آسیب نگردد. ژل را به مدت 20-25 دقیقه در دمای اتاق در بافر متعادل کننده SDS-PAGE قرار دهید. این بافر ، مشابه بافر نمونه در SDS-PAGE است. برای تهیه آن 12.5 میلی لیتر بافر ژل بالا، 1 گرم SDS، 5 میلی لیتر گلیسرول و 0.04 گرم دی تیو تریتول را در ظرفی مخلوط نموده ، با آب مقطر به حجم نهایی 50 میلی لیتر برسانید. برای رنگی شدن ان چند کریستال برموفنل بلو اضافه کنید.
- ژل لوله ای را روی ژل عمودی که قبلا برای SDS-PAGE آماده نموده اید، قرار دهید. برای این کار با کمک قاشقک با یک وسیله مناسب ژل لوله ای را بردارید و به دقت در حدفاصل شیشه ها روی ژل متراکم کننده قرار دهید به نحوی که حباب هوا تشکیل نشود.
قطر ژل لوله ای باید معادل ضخامت ژل عمودی یا کمتر از آن باشد. در ژل عمودی ، ژل بالا (ژل متراکم کننده) که ارتفاع آن حدود 1 سانتیمتر و بدون چاهک است، به متراکم شدن باندهای پروتئین و تفکیک بهتر آنها کمک می کند. با این حال اگر این بخش ژل نیز وجود نداشته باشد، ژل تیوب ژل می تواند نقش آن را ایفا کند، زیرا خصوصیاتی مشابه آن را دارد.
- برای اتصال کامل ژل لوله ای و ژل عمودی می توان از محلول آگارز 0.05 درصد با دمای 50-55 درجه سانتیگراد که قبلا آماده شده است، استفاده کرد. برای این کار پس از قرار دادن ژل لوله ای روی سطح ژل عمودی، مقدار 0.5-1 میلی لیتر از محلول آگارز روی ان اضافه نمایید. بهتر است قالب شیشه ای گرم باشد تا آگارز فرصت کافی برای نفوذ داشته باشد. اگر ژل لوله ای بطور محکم به ژل عمودی متصل نگردد، ممکن است پس از افزودن بافر الکترود به مخزن بالا، از جای خود بلند شود و از آن فاصله بگیرد.
برای تهیه آگارز 0.5 درصد، 0.2 گرم آگارز در در 40 میلی لیتر بافر حل نمایید. سپس مخلوط را در ظرف حاوی آب در حال جوشیدن قرار دهید تا کاملا حل شود. محلول ژل را در حمام آب با دمای 50-55 درجه سانتیگراد قرار دهید تا قبل از استفاده به دمای مربوطه برسد. بهتر است بعد از تهیه محلول آگارز ان را در حجم های کوچک تقسیم و در فریزر نگهداری کرد و در زمان نیاز محتویات یکی از ظروف را ذوب و استفاده کرد. در این صورت از انجماد و ذوب مکرر محلول آگارز جلوگیری می شود.
- بعد از اتمام SDS-PAGE ، ژل را از قالب شیشه ای خارج کنید و با روش مناسب رنگ آمیزی کنید.
رنگ آمیزی ژل های دو بعدی
تشخیص و بررسی پروتئین های تفکیک شده در ژل های دو بعدی به طور معمول به رنگ آمیزی این ژل ها با روشی مناسب نیازمند می باشد. برای رنگ آمیزی ژل های دو بعدی تاکنون روش های متعددی ارایه شده است. از جمله این روش ها می توان به رنگ آمیزی با رنگ های آلی (مثل کوماسی بلو) ، رنگ آمیزی نقره، رنگ امیزی معکوس و رنگ آمیزی فلورسانس اشاره کرد. به عنوان نمونه در اینجا رنگ آمیزی کوماسی G-250 کلوئیدی توضیح داده شده است.
رنگ آمیزی با کوماسی G-250 کلوئیدی
این روش از حساسترین روش های رنگ امیزی با کوماسی آبی است و حساسیت آن 20-30 نانوگرم پروتئین در هر باند تخمین زده می شود. با توجه به حالت کلوئیدی کوماسی در این روش تنها لکه های پروتئین رنگ می شوند و زمینه ژل آنچنان رنگی به خود نمی گیرد. اگر مواد مورد نیاز برای رنگ امیزی (بخصوص کوماسی G-250) از کیفیت مطلوب برخوردار نباشند، حساسیت این روش کمتر می شود و زمینه ژل نیز رنگ بیشتری به خود می گیرد.
مواد
- محلول ثبوت (تری کلرواستیک اسید 20 درصد). 20 گرم تری کلرواستیک اسید را در آب مقطر حل کرده ، حجم نهایی را به 100 میلی لیتر برسانید.
- محلول رنگ امیزی. 0.4 گرم کوماسی آبی G-250 را در 200 میلی لیتر آب مقطر حل کنید. سپس 200 میلی لیتر محلول اسید سولفوریک 1 مولار اضافه کنید. 3 ساعت با همزن مغناطیسی به هم زنید. محلول را با کاغذ صافی ، صاف کنید. سپس به ترتیب 45 میلی لیتر محلول هیدروکسید پتاسیم 10 مولار و 60 میلی لیتر محلول تری کلرواستیک اسید 100 درصد وزنی – حجمی اضافه کنید. محلول را در ظرف تیره بریزید و در دمای اتاق نگهداری کنید.
روش نگهداری
- ژل را در یک ظرف شیشه ای یا پلاستیکی درب دار قرار دهید. مقدار کافی محلول ثبوت اضافه کنید و حداقل یک ساعت روی شیکر با حرکت آرام قرار دهید. در صورتی که ژل روی طلق نگهدارنده تهیه شده و حاوی مواد سنگینی همچون گلیسرول است، آن را به صورت دمر در محلول ثبوت قرار دهید تا سریع تر از این مواد پاک شود.
- محلول ثبوت را تخلیه کنید. مقدار کافی محلول رنگ آمیزی اضافه کنید و ظرف را 3 ساعت در دمای 45-50 درجه یا در طول شب (حداقل 12 ساعت) در دمای اتاق روی شیکر با حرکت آرام قرار دهید.
- ژل را چندید بار در آب مقطر شستشو دهید تا زمینه آن شفاف گردد. این کار 1-2 ساعت طول میکشد.
مشاهده و آنالیز ژل
موضوع مرتبط : فیلم آموزشی کار با نرم افزار آنالیز تصاویر Image J
در پروتئومیکس کمی، نرم افزارها ابتدا با بررسی کمی پروتئین ها به صورت تکی و نشان دادن فاصله بین نقاط به آنالیز بیومارکرها در تصویر اسکن شده حاصل از ژل دو بعدی می پردازند. بعلاوه ، این ابزارها نقاط بین ژل های دارای نقاط مشترک را مطابقت می دهند. به عنوان مثال تفاوت پروتئومیک بین مراحل ابتدایی و حالات پیشرفته بیماری را با هم مقایسه می کنند. از جمله نرم افزارهایی که این کار را انجام می دهند عبارتند از:BIONUMERIC 2D، DELTA 2D، IMAGE MASTER، melanie، PDQuest، Progenesis، REDFIN. در حالی که این تکنولوژی بسیار مورد استفاده قرار می گیرد ، اما هنوز خیلی کامل نمی باشد.

شکل 3) روی هم انداختن نتایج ژل دو بعدی با استفاده از نرم افزار Delta 2D
فیلم آموزش تئوری اساس تکنیک الکتروفورز دو بعدی 2D (زبان انگلیسی)
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب مشابه :
- اصول PCR و کاربردهای آن، طراحی پرایمر
- دستگاه فرمانتور | بیوراکتور چیست؟
- کامل ترین مجموعه کروماتوگرافی |انواع و روشهای کروماتوگرافی| بیوتکنولوژی
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
- معرفی تجهيزات آزمايشگاهی
- رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامه ها
- رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- آموزش RSM| تحلیل نمودارهای آماری در روش سطح پاسخ | نرم افزار دیزاین اکسپرت