مطالب مرتبط:
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- راهنمای کامل الکتروفورز آگارز + تصویری | بیوتکنولوژی
- رفع اشکال کامل و تخصصی الکتروفورز DNA | ژل اگارز| بیوتکنولوژی
- تئوری و مبانی کامل ژل الکتروفورز +تصویری | بیوتکنولوژی
- اصول تکنیک الکتروفورز DGGE (ژل الکتروفورز با گرادیان شیب ماده دناتوره کننده)
- تکنیک الکتروفورز دو بعدی | بیوتکنولوژی
- الکتروفورز پروتئین سرم(SPEP) | روش اجرا | و شرح کامل اجزای سرم پروتئین
- ایزوالکتروفوکوسینگ | IEF | بیوتکنولوژی | الکتروفورز با نقطه ایزوالکتریک
تئوری و مبانی ژل الکتروفورز
ژل الکتروفورز یک متود جداسازی و آنالیز ماکرومولکولهای زیستی ( DNA، RNA و پروتئینها ) و قطعات آنها بر اساس اندازه و بار میباشد. این تکنیک در آزمایشگاه های تشخیصی جهت جداسازی پروتئینها با استفاده از بار و یا اندازه شان مورد استفاده قرار میگیرد و در بیوشیمی و دیگر گرایشهای علوم سلولی و مولکولی به منظور جداسازی قطعات دارای اندازههای مختلف DNA و RNA و مولکولهای پروتئینی بر اساس سایز میباشد. مولکولهای اسید نوکلئیکی با اعمال یک میدان الکتریکی در ژل آگارز و گاها ژل اکریل آمید حرکت میکنند و بر اساس اندازه جدا میشوند. مولکولهای کوچکتر سریعتر از مولکولهای بزرگتر حرکت میکنند؛ این امر به دلیل مهاجرت راحتتر آنها در منافذ ژل میباشد. اما پروتئینها بر اساس بارشان در آگارز جدا میشوند زیرا منافذ ژل بسیار بزرگتر از آن هستند که بتوانند پروتئینها را غربال نمایند. همچنین تکنیک ژل الکتروفورز میتواند به منظور جداسازی نانوذرات مورد استفاده قرار بگیرد.
از جمله کاربردهایی که ژل ها در هنگام الکتروفورز بر عهده دارند، مهار نمودن کنوکسیون دمایی ایجاد شده در اثر میدان الکتریکی، غربالگری و نیز ایجاد تاخیر در حرکت مولکولها میباشد. ژل الکتروفورز DNA معمولا به منظور تجزیه و تحلیل بعد از تکثیر DNA با استفاده از تکنیک PCR به کار میرود، اما ممکن است به عنوان یک تکنیک جهت آماده سازی برای تکنیکهای دیگر مانند اسپکترومتری جرمی ، RFLP ، PCR ، کلونسازی ، تعیین توالی DNA و یا ساترن بلاتینگ مورد استفاده قرار بگیرد.
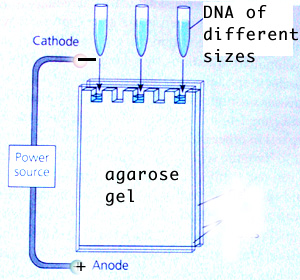
در میدان الکتریکی ایجاد شده توسط منبع تغذیه (Power-Supply ) مواد دارای بار خالص مثبت به سمت قطب منفی و مواد دارای بار خالط منفی به سمت قطب مثبت حرکت مینمایند.
شکل 1) جهت حرکت مولکولهای DNA در الکتروفورز آگارز
در ژل الکتروفورز آگارز پس از اعمال ولتاژ و جریان مورد نظر، مولکولهای با اندازه بزرگتر دارای حرکت کندتری در خلل و فرج ژل آگارز میباشند. همین اندازه مختلف مولکولها موجب ایجاد باندهای مجزا و متفاوتی خواهد شد. معمولا ژلهای انتخاب شده جهت عمل الکتروفورز، از جنس پلیمرهای دارای قدرت ایجاد پیوند متقاطع (crosslinked polymer) میباشند که نوع این پلیمر و نیز میزان نفوذپذیری آن بر اساس نوع ترکیب و وزن خاصی که قرار است جدا گردد، انتخاب میشود. هنگامی که قرار است پروتئینها و یا اسیدهای نوکلئیک کوچک از جنس DNA یا RNA جدا شوند، معمولا از غلظتهای متفاوتی ژل اکریل امید و کراسلینکر استفاده میشود که ایجاد شبکههای پلی اکریل آمیدی با اندازه منافذ مختلف ایجاد میگردند. اکریل آمید نوعی نوروتوکسین میباشد که باید بسیار با احتیاط استفاده شود. اما زمانی که اندازه اسیدهای نوکلئیک از چندصد جفت باز بیشتر گردد ، بهتر است از ژل آگارز جهت جداسازی استفاده گردد. آگارز متشکل از زنجیرهای بودن شاخه و بلند و بدون بار کربوهیدرات میباشد که کراس لینک نیز ندارند؛ همین امر موجب ایجاد ژل با اندازه منافذ بزرگ برای جداسازی ماکرومولکولها میگردد.
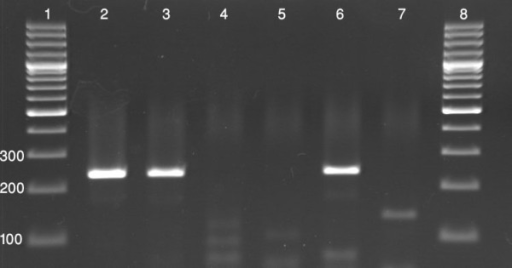
شکل 2) باند ژل الکتروفورز: هر باند نشان دهنده یک مولکول DNA خاص میباشد که دارای وزن مولکولی ویژه میباشد. باندهای سمت چپ و راست تصویر نشانگر ladder میباشند.
در هنگام عمل الکتروفورز بسته به اندازه و اختلاف وزنی که جمعیت مولکولها با هم دارند و نیز میزان ولتاژی که اعمال میگردد ، زمان الکتروفورز متفاوت خواهد بود. در صورتی که مدت زمان عمل الکتروفورز کم باشد روی هم افتادن باندها و نیز اسمیرهای غیر قابل تمایز قابل مشاهده خواهند بود. اما اگر مدت زمان این عمل زیاد باشد ممکن است مولکولها از ژل خارج گردند.
به منظور تشخیص وزن مولکولهای جداشده معمولا مارکرهای وزنی معینی وجود دارند که همگام با ران نمودن نمونهها ران میگردند. این مارکر که به Ladder نیز معروف میباشند، حاوی مخلوطی از مولکولهای دارای وزن مشخص میباشند. معمولا نکتههای که در مورد ladderها ضروری میباشد، این است که متناسب با جمعیت مولکولی که قرار است جدا شود، ladder را انتخاب نمود. این ladder باید حاوی مارکرهای دارای وزن کمتر و نیز بیشتر از مولکولی هدفی که قرار است جدا گردد، باشند. فاصلهای که یک باند طی مینماید متناسب است با لگاریتم اندازه مولکول.

شکل 3) مارکر DNA جهت نشان دادن وزن مولکولی باندهای جدا شده. این مارکز دارای 11 باندمشخص میباشد که دارای توالیهای بین 100 تا 1200 جهت باز میباشد.
عمل الکتروفورز در بافر صورت میگیرد تا از تغییرات pH جلوگیری بعمل آورد. در واقع pH فاکتوری بسیار اساسی و مهم در عمل الکتروفورز میباشد. همانگونه که پیشتر گفته شد، الکتروفورز تکنیکی بر اساس بار خالص و وزن مولکولمیباشد.
انواع ژل
مهمترین انواع ژل مورد استفاده در عمل الکتروفورز ژل آگارز و اکریل آمید میباشند. هر نوع ژل میتواند به خوبی برای انواع اندازهها و گونههای آنالیت مورد استفاده قرار بگیرد. ژلهای پلی اکریل آمید معمولا برای پروتئینها مورد استفاده قرار میگیرند و نیز دارای قدرت تفکیک خیلی بالایی برای قطعات DNA با اندازه بین 5-500 جفت باز میباشند. از طرف دیگر ژلهای آگارز دارای قدرت تفکیک کمتری برای DNA میباشند ولی دارای طیف وسیعتری از جداسازی میباشند و بنابراین برای قطعاتی DNA بین 50 تا 20000 جفت باز مناسب میباشند. اما باید این نکته در نظر گرفته شود که برای قطعات DNA بزرگتر از 6مگاباز باید با دستگاه الکتروفورز PFGE(PULSED FIELD GEL ELECTROPHORESIS) قطعات را جدا نمود.
نحوه تهیه این ژلها نیز با هم متفاوت میباشد. برای تهیه آگارز باید آن را به صورت محلول حرارت داد، اما برای تهیه پلی اکریل آمید باید آن را به طریق پلیمریزاسیون با استفاده از ماده شیمیایی تهیه نمود.
ژلهای آگارز دارای منافذ با اندازههای متفاوت میباشند ولی برای جداسازی پروتئینهای با اندازه بیشتر از 200 کیلودالتون میتوانند مورد استفاده قرار بگیرند. فاصله بین باندهای DNA دارای طول متفاوت متاثر از میزان درصد آگارز میباشد. اغلب ژلهای آگارز از درصد ژل بین 0.7 درصد (برای جداسازی قطعات DNA بین5 تا 10 کیلو باز )و 2 درصد (برای جداسازی قطعات بین 0.2 تا 1 کیلو باز) میباشند. ژلهای با درصد آگارز بالاتر از 3 ٪ را میتوان برای جداسازی قطعات خیلی کوچک استفاده نمود؛ اما برای این قطعات بهتر است از ژل پلی اکریل آمید به صورت عمودی برای جداسازی آنها استفاده شود. برای بسیاری از جداسازیها ژل 1 ٪ آگارز بهترین مورد میباشد.
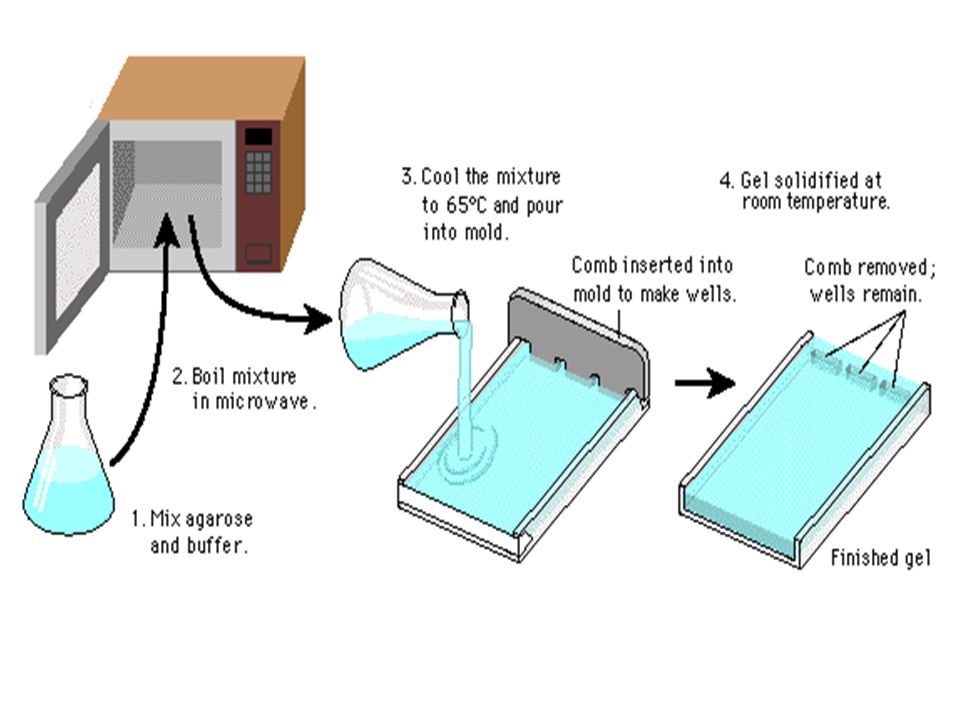
شکل 4) ژل آگارز تهیه شده و آماده برای بارگذاری نمونه. پس از حرارت دادن آگارز تا دمای ذوب کامل، آن را در همان حالت مذاب به داخل ژل تری (Gel-Tray) میریزند. قبل از ریختن ژل، شانه را در محل تعبیه شده در ژل تری قرار میدهند، تا پس از سرد شدن و بسته شدن ژل آگارز چاهکها به صورت مشخصی تشکیل شوند.
ژلهای پلی اکریل آمید (PAGE) به دلیل اندازه منافذ یکنواختی که درست کردهاند ، برای جداسازی پروتئینهای با اندازه بین 5 تا 2000 کیلودالتون مناسب میباشند. اندازه منفذ با تغییر میزان پودر اکریل آمید و بیس اکریل آمید بکار رفته در تهیه ژل تغییر میکند. این نوع ژل به دلیل ماهیت مواد اولیه خود که خطر آفرین میباشند کاربری کمتری نسبت به قبل دارد و بیشتر جهت جداسازی پروتئینها مورد استفاد قرار میگیرد.
در هنگام تهیه ژل اکریل آمید دو نوع ژل تهیه میشود: ژل Stacking و ژل Resolving .
ژل Stacking بر روی ژل Resolving ریخته میشود و درصد آن 5 ٪ میباشد. ولی ژل Resolving بین 6 تا 15 درصد تهیه میگردد. درصد انتخاب شده در این نوع ژل به اندازه پروتئین هدف بستگی دارد. هرچه که وزن آن کمتر باشد درصد اکریل آمید بکار برده بیشتر خواهد بود.
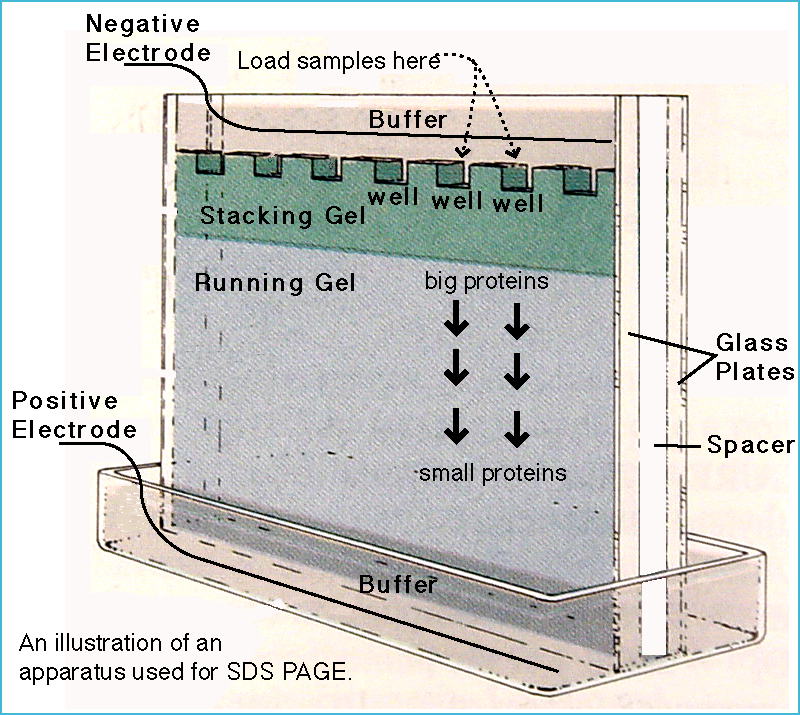
شکل 5) شماتیک الکتروفورز پروتئین.
نشاسته
نشاسته بدست آمده از سیب زمینی که به صورت نیمه هیدرولیز گردیده است نیز میتواند محیطی مناسب و غیر سمی جهت جداسازی پروتئینها ایجاد نماید. در این نوع ژل پروتئینهای غیردناتوره میتوانند بر اساس بار و وزن جدا شوند. ژل نشاسته معمولا بین 5 تا 10 درصد میباشد.
شرایط ژل
دناتوره نمودن
دناتوره نمودن ژلها معمولا در شرایطی که ساختار طبیعی آنالیت به هم ریخته میشود و به صورت خطی در میآید، ایجاد میشوند. هنگامی که ماکرو مولکولها دناتوره میگردند، حرکت آنها بر روی ژل تنها به اندازه خطی و نیز نسبت جرم به بارشان بستگی خواهد داشت. بنابراین ساختارهای دوم، سوم و چهارم آنها از بین خواهد رفت که تنها ساختار اولیه جهت آنالیز باقی خواهد ماند. اسیدهای نوکلئیک اغلب با افزودن اوره در بافر دناتور میگردند، اما پروتئینها با استفاده از سدیم دودسیل سولفات (SDS) دناتوره میگردند که این در واقع قسمتی از ژل SDS-PAGE خواهد شد. به منظور دناتوراسیون کامل پروتئینها ، لازم است باندهای دیسولفید آنها که ایجاد پیوند کوالان کردهاند و ساختار سوم و چهارم آنها را پایدار نموده است توسط یک روش به نام Reducing PAGE از بین برود. معمولا با استفاده از بتا مرکاپتو اتانول و یا دیتیوتریتول این باندها شکسته میشوند. Reducing PAGE معمولترین شیوه رایج الکتروفورز پروتئین میباشد.
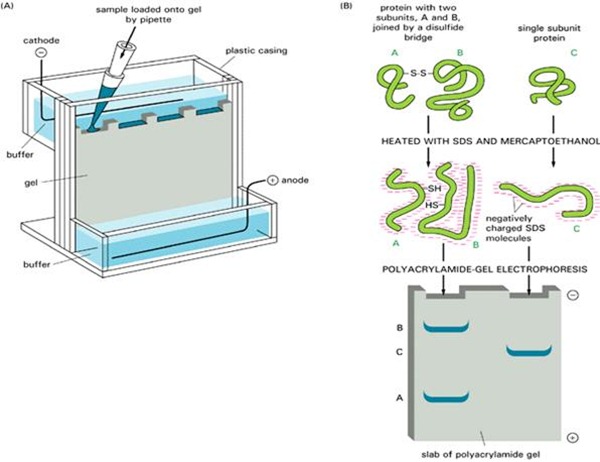
شکل 6) نحوه خطی سازی پروتئینها در تکنیک SDS-PAGE
در اسیدهای نوکلئیک شرایط دناتوره برای تخمین دقیق وزن مولکولی RNA ضروری میباشد. مولکولهای RNA قادراند برهمکنشهای درون مولکولی بیشتری نسبت به DNA ایجاد کنند که این امر بر روی تحرک الکتروفورزی آنها تاثیر بسزایی خواهد داشت. اوره، DMSO و گلای اکسال معمولترین عوامل دناتوره کننده برای تخریب ساختار RNA میباشند.
ژل Native
ژل های native در شرایطی غیر-دناتوره کننده ران میشوند ، بنا براین ساختار طبیعی آنالیت حفظ میشود. این امر موجب تاثیر گذاری شکل مولکول در تحرک آن خواهد شد و بنابراین هر چهار سطح پروتئین قابل بررسی خواهند بود. از آنجایی که در این نوع ژلها ساختار طبیعی پروتئینها حفظ میشود، نتنها میتوان آنها را استفاده از روشهای رنگ آمیزی معمول بررسی نمود، بلکه همچنین میتوان با استفاده از روشهای رنگ آمیزی ویژه enzyme-linked آنها را بررسی نمود. ژل الکتروفورز native معمولا برای تحقیقات پروتئومیکس و متالومیکس مورد استفاده قرار میگیرد. اگرچه، native-PAGE نیز میتواند برای اسکن ژلهای حاوی جهشهای ناشناخته مانند تکنیک SSCP مورد استفاده قرار بگیرند.
بافرها
نقش بافرها در الکتروفورز فراهم نمودن یونهای حامل جریان بین دو قطب و نیز حفظ نمودن pH محیط انجام الکتروفورز میباشد. بافر تریس- استات- EDTA ( TAE) و بافر تریس- بورات- EDTA (TBE) از جمله مهمترین بافرهای مورد استفاده برای اسیدهای نوکلئیک میباشند. بافر TAE دارای ظرفیت بافری پایینی میباشد ، اما کیفیت نتایج آن برای توالی های DNA با طول بلند بسیار خوب میباشد. بافرهای دیگری نیز برای الکتروفورز آگارز استفاده میشود که از عمومیت کمتری برخوردارند.
اما اغلب جداسازیهای پروتئینی تکنیک SDS-PAGE با استفاده از سیستم DISC بافر صورت میگیرند که به طرو قابل ملاحظهای کیفیت باندهای بدست آماده را افزایش میدهد.
مشاهده باندهای جدا شده در سیستم الکتروفورز
بعد از اتمام عمل الکتروفورز، باید جهت مشاهده مولکولهای موجود در ژل، آنها را رنگامیزی نمود. DNA را میتوان با استفاده از اتیدیوم برماید رنگ آمیزی نمود. این رنگ هنگامی که بین دو رشته DNA قرار میگیرد، تحت نور فرابنفش ، فلوئورسانس ساتع میکند.
رنگهای نقره و کماسی برلیانت بلو جهت مشاهده پروتئینها استفاده میشوند. روشهای دیگری ممکن است جهت مشاهده جداسازی اجزای موجود در ژل استفاده شوند. معمولا به منظور عکس برداری از ژلهای رنگآمیزی شده از دستگاه ژل داک استفاده میکنند.

دیدگاهها