توضیح کامل تکنیک SDS-PAGE
مطالب مرتبط:
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- راهنمای کامل الکتروفورز آگارز + تصویری | بیوتکنولوژی
- رفع اشکال کامل و تخصصی الکتروفورز DNA | ژل اگارز| بیوتکنولوژی
- تئوری و مبانی کامل ژل الکتروفورز +تصویری | بیوتکنولوژی
- اصول تکنیک الکتروفورز DGGE (ژل الکتروفورز با گرادیان شیب ماده دناتوره کننده)
- تکنیک الکتروفورز دو بعدی | بیوتکنولوژی
- الکتروفورز پروتئین سرم(SPEP) | روش اجرا | و شرح کامل اجزای سرم پروتئین
- ایزوالکتروفوکوسینگ | IEF | بیوتکنولوژی | الکتروفورز با نقطه ایزوالکتریک
تکنیک SDS-PAGE یک روش کم هزینه سریع و تکرار پذیر جهت مطالعه پروتئین ها می باشد. این روش به طور معمول برای بررسی ماحل خالص سازی، محاسبه مقدار نسبی و تعیین وزن مولکولی پروتئین ها بکار می رود. در تکنیک SDS-PAGE به دلیل استفاده از ماده سدیم دودسیل سولفات (SDS)و همچنین ویژگی های عالی ژل پلی اکریل آمید قدرت تفکیک پروتئین ها بسیار خوب می باشد. SDS یک دترجنت آنیونی می باشد که با اتصال به نواحی هیدروفوب پروتئین ها آنها را دناتوره می کند. در واقع مولکول SDS با اتصال به پروتئین ها بار طبیعی آنها را می پوشاند و توزیع یکنواختی از بارهای منفی بر روی آن ایجاد می نماید. در نتیجه این اتفاق، جداسازی پروتئین ها تنها بر اساس وزن مولکولیشان صورت می گیرد. جهت خطی نمودن مولکول های پروتئینی، آنها را در مقدار کافی SDS ، و ماده احیا کننده مرکاپتو اتانول جهت از بین بردن باندهای دی سولفیدی و نیز دقایقی حرارت قرار می دهند. مقدار SDS لازم جهت اتصال به پروتئین ها، 1.4 گرم SDS به ازای هر گرم پروتئین می باشد. حالا در هنگام ران نمودن الکتروفورز جداسازی پروتئین ها تنها بر اساس وزن مولکولی شان خواهد بود. بدین معنا که هرچه اندازه مولکول بزرگتر باشد، حرکت آن به دلیل اصطکاک با محیط اطراف کمتر خواهد بود.
شکل 1) مکانیسم عمل SDS
معمولا مولکول SDS به قندها متصل نمی گردد، از این رو پروتئین هایی که بخش قندی آنها بزرگ است، نسبت به وزن مولکولی خود SDS کمتری می گیرند. با کاهش اتصال مولکول های SDS در آنها، حرکت کندتری بر روی ژل خواهند داشت. این امر موجب تخمین وزن آنها بیش از وزن طبیعیشان میشود. جهت حل این مشکل، میتوان SDS-PAGE را در ژل های دارای شیب غلظتی یا در سیستم های بافری تریس- بورات- SDTA به جای بافر معمول تریس –گلیسین قرار داد. بورات با اتصال به قندها، موجب افزایش میزان بار منفی گلیکوپروتئین خواهد شد و تا حدود زیادی کاهش اتصال به SDS جبران خواهد شد.
اثر ژل پلی اکریل آمید
ژل پلی اکریل آمید نقش بسیار موثری در تفکیک پروتئین ها در SDS-PAGE دارا می باشد. قطر منافذ موجود در ژل پلی اکریل آمید که متاثر از غلظت دو جزء سازنده آن می باشد (C % , T %) دامنه وزنی قابل تفکیک در SDS-PAGE را مشخص می کند. به عنوان مثال در ژل با غلظت 5، 10 و یا 15 ٪ (با فرض C معادل 2.6 درصد) به ترتیب می توان پروتئین های در محدوده 20-300 ، 15-200 و 12-100 کیلو دالتون را جدا نمود. باید در نظر گرفت که رابطه مسافت طی شده و لگاریتم وزن مولکولی در محدوده کمی به صورت خطی می باشد. به منظور افزایش میزان این رابطه خطی، باید الکتروفورز را در شیبی از غلظت ژل پلی اکریل آمید انجام داد.
تکنیک SDS-PAGE در شرایط احیایی و غیراحیایی
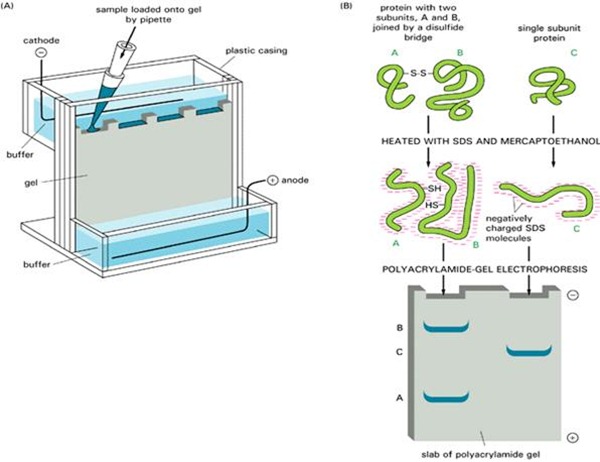
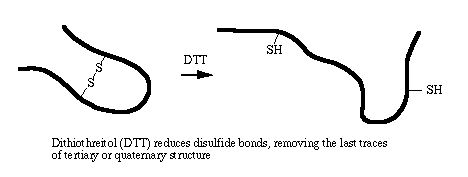
پیوندهای دی سولفیدی درون رنجیره ای یا بین زنجیره ای نقش عمده ای در شکل گیری ساختمان سوم و چهارم پروتئین ها دارند. احیای این پیوندها با استفاده از مواد تیول دار (مانند 2- مرکاپتو اتانول) منجر به از بین رفتن ساختمان های سوم و چهارم پروتئین ها خواهد شد. پروتئین های دارای پیوند دی سولفیدی ، دارای حرکت متفاوتی در شرایط احیایی و غیر احیایی الکتروفورز می باشند. احیا شدن این پیوندهای دی سولفیدی موجب جدا شدن زیرواحدهای پروتئینی در پروتئین های چند زیر واحدی و همچنین خطی شدن کلیه پروتئین ها می شود که این امر موجب اتصال یکنواخت SDS به پروتئین خواهد شد. بنا براین میتواند با مقایسه الگوی الکتروفورز احیایی و غیر احیایی یک پروتئین اطلاعات زیادی راجع به ساختار سوم آن بدست آورد. DTT و 2- مرکاپتو اتانول رایج ترین احیا کننده های پیوند دی سولفیدی می باشند.
شکل 2) مکانیسم عمل مرکاپتو اتانول
سیستم بافری
ژل پلی اکریل آمید از دو قسمت ژل متراکم کننده (Stacking gel) و ژل جداکننده (resolving gel) تشکیل شده است. ژل متراکم کننده در بالا قرار گرفته است و مواد تشکیل دهنده آن با ژل جدا کننده متفاوت می باشد. در ژل متراکم کننده به دلیل تراکم یکسان بار الکتریکی کلیه پروتئین ها حرکت آنها با سرعت یکسانی می باشد و به صورت یک لایه نازک در می آیند. اما با رسیدن مجموعه پروتئینی به ابتدای ژل جدا کننده ، جداسازی آنها بر اساس وزن مولکولی شروع می شود. بار خالص پروتئین- SDS در دامنه PH بین 7-10 تغییر چندانی نمی کند و حرکت پروتئین ها در این دامنه نیز تفاوت محسوسی ندارد.
بافر تریس-گلیسین پر استفاده ترین سیستم بافری ناپیوسته در SDS-PAGE می باشد. در سیستم بافری ناپیوسته ترکیب یونی ، PH بافر در نمونه، ژل و مخازن با یکدیگر متفاوت می باشد. درسیستم بافری ناپیوسته حتی ژل نیز غالبا شامل دو قسمت (ژل بالا و ژل پایین) می باشد. در سیستم بافری ناپیوسته کارایی الکتروفورز خیلی وابسته به حجم نمونه نمی باشد.
در سیستم بافری پیوسته غلظت و ترکیب یون ها و PH در سراسر مسیر الکتروفورز یکسان می باشد.
سیستم بافری لاملی متداولترین سیستم بافری ناپیوسته در الکتروفورز می باشد. در این سیستم نمونه پروتئین و و ژل بالا حاوی بافر تریس- هیدروکلرید با PH=6.8 و ژل پایین حاوی بافر تریس هیدروکلرید با PH=8.8 و بافر مخازن (بافر الکترودها) شامل تریس-گلیسین با PH=8.3 می باشد.
آماده سازی نمونه
برای آماده سازی نمونه در SDS-PAGE بافر نمونه را با نسبت خاصی به نمونه می افزایند ، سپس برای دقایقی در آب جوش قرار می دهند. در این شرایط پروتئین ها به واسطه اثر SDS و ماده احیا کننده (در حالت الکتروفورز احیایی) کاملا دناتوره می شوند. میزان SDS در بافر نمونه باید بارها بیشتر از میزان پروتئین باشد (میزان 3 به 1) تا کاملا از اشباع شدن پروتئین با SDDS اطمینان حاصل شود.
وجود گلیسرول یا ساکارز در بافر نمونه باعث سنگین شدن نمونه و قرار گرفتن آن در ته چاهک می شود. این موضوع خصوصا زمانی اهمیت بالایی پیدا می کند که مدت زمان نمونه گذاری زیاد طول بکشد.
در SDS-PAGE معمولا بعد از افزودن بافر نمونه به پروتئین و قبل از نمونه گذاری ، مخلوط آنها را دقایقی (15 -20 دقیقه بسته به نوع پروتئین) در آب جوش قرار می دهند. حرارت موجب جداشدن زیرواحدهای پروتئینهای چند زیرواحدی و تسهیل اشباع شدن زنجیرهای پلی پپتیدی با استفاده از SDS می شود. بعلاوه، این کار موجب غیر فعال شدن بسیاری از پروتئیازها شده و امکان تجزیه پروتئین ها توسط آنها را از بین خواهد برد. اما با این وجود بسیار از پروتئیازها در این شرایط سالم باقی می مانند و لازم است مهار کننده پروتئیاز به نمونه ها افزوده شود.
بعضی پروتئین ها تحت تاثیر SDS تنها، رفتاری مشابه با حالت تحت تاثیر SDS و حرارت دارند ولی بعضی پروتئین ها در هر حالت رفتار متفاوتی از خود بروز می دهند.
مواد لازم جهت انجام SDS-PAGE
- محلول استوک اکریل آمید (30.8 درصد): 30 گرم آکریل آمید و 0.8 گرم بیس اکریل آمید را زیر هود وزن کنید و در آب مقطر تا حجم نهایی 100 میلی لیتر حل نمایید. محلول را با کاغذ واتمن شماره 1 صاف کنید و در ظرف تیره بریزید. این محلول تا 3 ماه در یخچال قابل استفاده است.
نکته: از استنشاق پودر اکریل آمید و بیس اکریل آمید در هنگام توزین و تماس با محلول آنها خودداری نمایید.
- بافر ژل پایین:18.2 گرم تریس باز و 0.4 گرم SDS را در 70 میلی لیتر آب مقطر حل نمایید. PH محلول را با اسید کلریدریک 2 مولار به 8.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 1.5 مولار است.
- بافر ژل بالا:6.1 گرم تریس باز و 0.4 گرم SDS را در 50 میلی لیتر آب مقطر حل نمایید. با اسید کلریدریک 2 مولار PH آن را به 6.8 برسانید. سپس آب مقطر تا حجم نهایی 100 میلی لیتر اضافه کنید. غلظت تریس در این بافر 0.5 مولار است.
- بافر الکترود (بافر مخازن):3 گرم تریس باز، 14.4 گرم گلیسین و 1 گرم SDS را در 1 لیتر آب مقطر حل کنید، PH این بافر حدود 8.3 می باشد و نیاز به تنظیم ندارد.
- بافر نمونه (5X): 10 میلی لیتر بافر ژل بالا، 5 میلی لیتر گلیسرول، 1 گرم SDS، 0.2 میلی لیتر محلول بروموفنلبلو (0.5 درصد در اتانول) و 1 میلی لیتر 2-مرکاپتواتانول را در یک ظرف مخلوط نمایید. سپس با آب مقطر به حجم نمایی 20 میلی لیتر برسانید.
- پرسولفات آمونیوم 10 درصد: 1/0 گرم پرسولفات آمونیوم در 1 میلی لیتر آب مقطر حل کنید. این محلول باید تازه تهیه شود.
- TEMED 10 درصد:1/0 میلی لیتر TEMED در 9/0 میلی لیتر آب مقطر حل کنید. این محلول باید به صورت تازه تهیه شود.
- مارکرهای وزن مولکولی نیز آماده باشند.
انجام آزمایش
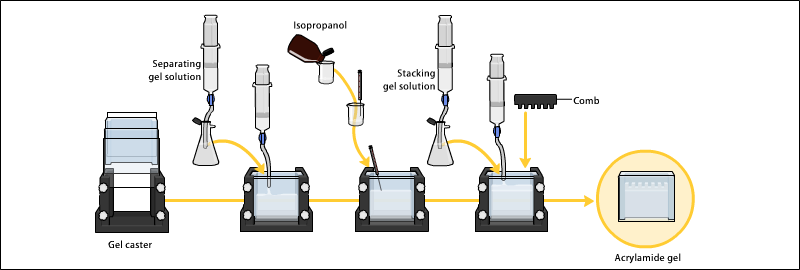
- ابتدا قبل از انجام هر گونه آزمایش، پلیت ها، اسپیسرها و شانه ها را در یک دترجنت آزمایشگاهی شسته. دقت شود که از مواد خورنده جهت شستوشو استفاده نشود. در صورتی که ژل برای مراحل بعد مانند رنگ آمیزی با نقره مورد نیاز باشد، توصیه می شود که شیشه ها را به صورت شبانه در کرومیک اسید انکوبه نمایید و سپس با آب مقطر شسته و در نهایت با اتانول ، استون و اتانول به ترتیب شستوشو دهید. هیچگاه اجازه ندهید کرومیک اسید و یا حلال های آلی با ترکیبات پلاستیکی تماس داشته باشند. در نهایت شیشه ها را با دستان پوشیده شده با دستکش تمیز بردارید.
- سر هم کردن پلیت ها:
برای سر هم نمودن ابتدا شیشه مستطیل شکل را روی یک سطح کاملا صاف قرا دهید، سپس اسپیسرها را مطابق شکل روی آن قرار دهید (در مدلهای جدید اسپیسر به شیشه مستطیل چسبیده است و نیاز به قرار دادن آن روی شیشه ندارید)، سپس شیشه U-شکل را روی آن قرار دهید. در این مرحله دقت شود که هر دو شیشه روی هم به صورت کاملا تراز قرار دارند.
شکل 1) نحوه سر هم کرد شیشه ها
- حالا شیشه های روی هم قرار گرفته را مطابق شکل زیر در دستگاه قرار داده. برای این کار تنها لازم است پیچ های دو طرف دستگاه را شل نمایید و شیشه ها را در آن قرار دهید. برای شیشه های سمت دیگر دستگاه نیز همین کار را تکرار نمایید.
شکل 2) گذاشتن ژل در دستگاه
- جهت تراز نمودن کامل مطابق شکل زیر با نوک انگشت بررسی شود که آیا شیشه ها کاملا به هم تراز هستند یا نه. در صورت تراز بودن شیشه ها با هم پیچ های دو طرف دستگاه را بسته تا شیشه ها جابجا نشوند. جهت اطمینان از عدم نشت دهی دستگاه، یک قطره کوچک وازلین در ته دستگاه به دو طرف شیشه ها (کنار اسپیرها) بزنید.
شکل 3) بررسی تراز بودن شیشه ها
- حالا دستگاه را برداشته ومطابق شکل زیر روی تخته ژل قرار دهید و پیچ های تخته ژل را مطابق علامت روی آن سفت کنید. برای اطمینان از بسته شدن درست دستگاه، نشتی آن را با آب مقطر تست کنید.
شکل 4) قرار دادن دستگاه روی تخته ژل
ریختن ژل پایین (ژل جدا کننده)
محلول ژل پایین را از اجزای آن با توجه به درصد آن تهیه نمایید. نحوه تهیه 12 میلی لیتر از محلول ژل پایین در جدول زیر آمده است.
| اجزای ژل پایین | درصد T | |||||
| 7.5 % | 10 % | 12.5% | 15% | 17.5% | 20% | |
| بافر ژل پایین | 3 ml | 3 ml | 3ml | 3ml | 3ml | 3ml |
| محلول استوک اکریل آمید | 2.9% | 3.9% | 4.9 % | 5.9 % | 6.8 % | 7.8 % |
| آب مقطر | 6.1% | 5.1% | 4.1% | 3.2% | 2.2% | 1.2% |
| پر سولفات آمونیوم 10 ٪ | 0.05% | 0.05% | 0.05% | 0.05% | 0.05% | 0.05% |
| 10 ٪ TEMED | 0.05% | 0.05% | 0.05% | 0.05% | 0.05% | 0.05% |
جدول 1) تهیه 12 میلی لیتر محلول ژل پایین با غلظت های مختلف
اجزای ژل پایین به غیر از TEMED را در یک ظرف مناسب مخلوط نمایید. محلول را حدود 30 ثانیه با پمپ خلا از هوا تخلیه کنید. سپس TEMED را اضافه کنید. پس از هم زدن سریع ، محلول را در بین شیشه ها تا ارتفاع مناسب بریزید. باید دقت شود که حدود 3 سانتیمتر فضا برای ژل بالا لازم می باشد. حدود 0.5 میلی لیتر آب مقطر با سمپلر به آرامی از کنار شیشه روی سطح ژل بریزید، به نحوی که با ژل مخلوط نگردد. انعقاد ژل پایین معمولا 15-45 دقیقه طول می کشد. ژل منعقد شده به وضوح از آب مقطر روی آن (به دلیل تفاوت در ظریب شکست نور) قابل تشخیص می باشد.
تهیه ژل بالا (ژل متراکم کننده)
بعد از انعقاد ژل پایین، مطابق جدول زیر ژل بالا را تهیه نمایید.
| اجزای ژل بالا | درصد T | ||
| 3 ٪ | 4 ٪ | 5 ٪ | |
| بافر ژل بالا | 1.25 ml | 1.25 ml | 1.25 ml |
| محلول استوک اکریل آمید | 0.5 ml | 0.65 ml | 0.81 ml |
| آب مقطر | 3.2 ml | 3.05 ml | 2.9 ml |
| پرسولفات آمونیوم | 0.05 ml | 0.05 ml | 0.05 ml |
| TEMED 10 ٪ | 0.015 ml | 0.015 ml | 0.015 ml |
جدول 2) تهیه 5 میلی لیتر محلول ژل بالا با غلظت های 3 ، 4 و یا 5 درصد.
معمولا غلظت این ژل 3، 4 و یا 5 ٪ است. اجزای ژل بالا غیر از TEMED را در ظرف مناسبی مخلوط کنید. آب روی ژل پایین را کاملا خالی کنید. برای حذف قطرات باقیمانده آب، حدود 1 میلی لیتر محلول ژل بالا را در جدار داخلی شیشه بگردانید و مجددا تخلیه نمایید. به بقیه محلول ژل بالا TEMED اضافه نمایید و پس از هم زدن سریعا تا ارتفاع مناسب روی ژل پایین بریزید سپس شانه را با دقت در ژل بالا فرو کنید، به طوری که دندانه های آن حدود 1.5 سانتیمتر از سطح ژل فاصله داشته باشند. معمولا ژل بالا در کمتر از 15 دقیقه می بندد (کناره دندانه های شانه از ژل منعقد شده قابل تشخیص است). بهتر است قبل از دو آوردن شانه ، انتهای دندانه آن را روی شیشه با ماژیک مشخص کنید تا نمونه گذاری و تشخیص چاهک ها راحت باشد.
آماده سازی جهت ران
پس از بسته شدن ژل بالا، شانه ها را از آن خارج نموده و دستگاه را به دورن تانک قرار دهید. مخازن تانک و دستگاه را تا ارتفاع مناسب به ترتیب با بافر الکترود و بافر نمونه پر کنید. هر گونه حباب در انتهای ژل را با تزریق بافر توسط سرنگ خارج نمایید.
افزودن نمونه ها:
یک حجم بافر نمونه (5 X) را به 4 حجم نمونه پروتئین اضافه نمایید. اگر پروتئین به صورت پودر است، مقدار مورد نیاز آن را در بافر نمونه که 5 بار با آب مقطر رقیق شده (بافر 1 X) ، حل کنید. نمونه و بافر نمونه را در یک ظرف کوچک درب دار ریخته و به مدت 5 دقیقه در ظرف آب جوش قرار دهید. در صورت کدورت نمونه و یا وجود ذرات نامحلول، آن را به مدت 10 دقیقه در دور 10/000 g. سانتریفیوژ نمایید.سپس با سرنگ هامیلتون یا سمپلر مناسب 10-20 میکرولیتر از هر نمونه را به دقت در چاهک بریزید. به دلیل وجود گلیسرول، نمونه در ته چاهک قرار میگیرد. مقدار پروتئین موجود در هر چاهک به میزان خلوص نمونه و روش رنگ آمیزی بستگی دارد.
حالا سیم های رابط را به الکتروفورز وصل نمایید و برای الکتروفورز در جریان الکتریکی ثابت، شدت جریان 20-30 میلی آمپر را تنظیم نمایید. در این حالت رنگ نشانگر (بروموفنل بلو) طی مدت 1.5 تا 2 ساعت به انتهای ژل می رسد.
پس از اتمام عمل الکتروفورز، جریان را قطع نمایید و دستگاه را از تانک بیرون آورید. سپس پیچ های آن را شل نمایید و شیشه های حاوی ژل را با دقت بردارید. با استفاده از کاردک همراه دستگاه به آرامی شیشه ها را از هم جدا کنید و ژل را برداشته. در صورت لزوم ژل را رنگ آمیزی کنید.
رنگ آمیزی
رنگ آمیزی پروتئین ها در ژل پلی اکریل آمید با روش های متنوعی امکان پذیر است. کوماسی بلو (انواع R و G)[1] و نقره از پر استفاده ترین مواد برای رنگ آمیزی پروتئین ها هستند. در اینجا رنگ آمیزی با کماسی بلو که بسیار متداول می باشد ، توضیح داده می شود.
رنگ آمیزی با کوماسی بلو R-250
کوماسی بلو R-250 معمولترین رنگ برای رنگ آمیزی پروتئین ها است. سادگی رنگ آمیزی، هزینه کم، ثبات رنگ برای مدت طولانی و حساسیت نسبتا بالا از مزایای آن می باشند. حساسیت این روش 0.5-0.2 میکروگرم پروتئین در هر باند می باشد. در این روش مراحل تثبیت و رنگ آمیزی پروتئین ها به طور همزمان صورت می گیرد.
شکل 5) حمام رنگ جهت رنگ آمیزی پروتئین ها در ژل اکریل آمید.
مواد
- محلول رنگ آمیزی: 0.25 گرم کوماسب بلو R-250 را در 125 میلی لیتر متانول حل کنید. سپس 25 میلی لیتر اسید استیک گلاسیال و 100 میلی لیتر آب مقطر اضافه نمایید. غلظت رنگ در این محلول حدود 0.1 درصد وزنی/حجمی است. قبل از استفاده محلول رنگ را با کاغذ واتمن شماره 1 صاف کنید. این محلول می تواند به عنوان تثبیت کننده پروتئین ها نیز عمل کند.
- محلول رنگ بر: 200 میلیلیتر متانول، 100 میلی لیتر اسید استیک گلاسیال و 700 میلی لیتر آب مقطر را به هم بیفزایید.
روش رنگ آمیزی
- ژل را در ظرف درب دار قرار دهید. حجم کافی از محلول رنگ (مثلا 100 میلی لیتر برای یک ژل کوچک) اضافه کنید. در ظرف را بسته و آن ربا 1-2 ساعت روی شیکر قرار دهید. این مدت زمان برای رنگ آمیزی ژلی با غلظت 10 ٪ و ضخامت پ میلی لیتر کافی است.
- محلول رنگ را تخلیه کنید. ژل را کاملا با آب معمولی شسته، سپس محلول رنگ بر اضافه کنید. در ظرف را بسته، آن را روی شیکر قرار دهید. پس از تیره شدن محلول رنگ بر، آن را با محلول تازه تعویض کنید. این عمل را چند بار تکرار کنید تا زمینه ژل شفاف گردد و باندهای پروتئینی به وضوح مشاهده شوند.
- ژل را در محلول 7 درصد اسید استیک قرار دهیدو در ظرف را ببنیدید. ژل در این حالت برای مدت طولانی قابل نگهداری است.
تعیین وزن
در تکنیک SDS-PAGE مولکولهای پروتئینی با استفاده از سدیم دودسیل سولفات به صورت خطی در می آیند و حرکت آنها بر اساس وزن میباشد. همانگونه که پیش تر نیز ذکر شد، مسافت طی شده پروتئین ها با لگاریتم وزن مولکولی آنها رابطه خطی دارد. پس هرچه پروتئین بزرگتر باشد مسافت طی شده کمتر خواهد بود.
به طور معمول در زمان بارگیری نمونه ها، در یکی از چاهک ها مارکر پروتئینی نیز اضافه می کنند. مارکرهای پروتئینی متشکل از چندین پپتید با وزن مولکولی مشخص می باشند. با مقایسه نمودن میزان حرکت پروتئین مورد نظر بر روی ژل با مارکر های پروتئینی با استفاده از رسم نمودار حرکت نسبی می توان وزن مولکول هدف را تخمین زد.
شکل 6) مارکر مورد استفاده در تکنیک SDS-PAGE به همراه پروتئین های مورد بررسی
[1] R= Reddish hue & G= Greenish hue
رفع اشکال تکنیک الکتروفورز عمودی (SDS-PAGE)
در ذیل لیستی از مشکلات احتمالی تکنیک الکتروفورز پروتئین آمده است که توضیحات آن نیز در کنار هر کدام ذکر شده است.
-
مشکل:عدم پلیمریزاسیون یا پلیمریزاسیون ناقص ژل
علت: پایین بودن دمای محلول ها
رفع مشکل:قبل از استفاده لازم است دمای محلول ها به دمای محیط برسد (20-30 درجه سانتیگراد)
علت: کهنگی یا کم بودن مقدار کاتالیزورها مخصوصا پرسولفات آمونیوم
رفع مشکل: محلول تازه پرسولفات آمونیوم تهیه گردد. مقداری بیشتری پرسولفات آمونیوم به محلول ژل اضافه گردد.
علت:کهنه بودن محلول استوک اکریل آمید
رفع مشکل:محلول تازه اکریل آمید تهیه شود.
علت:اثر اکسیژن هوا به خصوص در محلول های سرد
رفع مشکل:دمای محلول ها به دمای محیط برسد. محلول ژل هواگیری شود.
علت:غلظت بالای ماده احیا کننده 2-مرکاپتواتانول در ژل
رفع مشکل:در صورت امکان 2-ME را در غلظت کم به ژل اضافه کنید یا آن را در محلول ژل وارد نسازید.
-
مشکل:منعقد نشدن بخشی از ژل اکریل آمید در قالب شیشه ای
علت:مخلوط نشدن پرسولفات آمونیوم در محلول ژل مخصوصا در ژل های غلیظ
رفع مشکل:بعد از افزودن پر سولفات آمونیوم به محلول ژل، آن را کاملا مخلوط کنید.
-
مشکل: جدا شدن ژل از شیشه یا طلق های قابل اتصال به ژل
علت: کثیف بودن سطح شیشه
رفع مشکل:سطح شیشه را کاملا تمیز نمایید.
علت: انعقاد ژل روی سطح آبگریز طلق یا کهنه بودن آن
رفع مشکل:سطح آبدوست طلق به طرف ژل قرار گیرد. از طلق تازه استفاده شود.
-
مشکل:چروکیده شدن ژل
علت: گرمای زیاد حاصل از پلیمریزاسیون در ژل های با درصد بالا
رفع مشکل: محلول ها خنک گردد. سرعت پلیمریزاسیون با تغییر مقدار پرسولفات آمونیوم کنترل شود.
علت:گرمای زیاد در هنگام الکتروفورز به دلیل مقاومت الکتریکی.
رفع مشکل: الکتروفورز در جریان الکتریکی کمتر و در مدت طولانی تری صورت گیرد.
علت:بالا بودن ضخامت ژل یا درصد ژل در هنگام خشک کردن یا قطع جریان برق در هنگام خشک شدن ژل در دستگاه خشک کن
رفع مشکل:قبل از خشک کردن، ژل را نیم ساعت در محلول حاوی متانول 20-30 درصد و گلیسرول 3 درصد قرار دهید.
-
مشکل:چاهک های نامنظم و ناقص در ژل بالا (Stacking gel)
علت: احتباس هوا در انتها یا کناره دندانه های شانه
رفع مشکل: شانه را خارج ساخته ، مجددا در محل خود قرار دهید، به نحوی که حباب هوا نداشته باشد.
علت: خارج ساختن شانه قبل از کامل شدن انعقاد ژل بالا
رفع مشکل:پس از اطمینان از انعقاد ژل بالا، شانه را خارج نمایید، چاهک ها را با بافر الکترود بشویید.
-
مشکل:حرکت بیشتر رنگ نشانگر در بخش میانی ژل
علت:بالا بودن دمای بخش میانی به دلیل تبادل حرارتی کمتر با محیط
رفع مشکل:برای تبادل حرارتی یکسان از سیستم سیرکولاتور استفاده شود. در غیر این صورت در ولتاژ یا توان پایین کار کنید.
-
مشکل:وجود باند قوی در ابتدای ژل جدا کننده
علت:وجود تجمعات بزرگ و نامحلول پروتئین یا لیپوپروتئین در نمونه (مخصوصا در PAGE)
رفع مشکل: نمونه را قبل از الکتروفورز 15 دقیقه در 20/000xg سانتریفیوژ نمایید. الکتروفورز را در حضور مواد تسهیل کننده حلالیت پروتئین ها انجام دهید.
علت: وجود ژل متراکم کننده (معمولا در page)
رفع مشکل:در سیستم بافری پیوسته الکتروفورز را انجام دهید.
علت: بالا بودن درصد ژل نسبت به وزن مولکولی عده ای از پروتئین های موجود در نمونه
رفع مشکل:در صورت امکان درصد ژل را پایین آورید، یا الکتروفورز را در ژل با شیب غلظت انجام دهید.
علت:کاهش غلظت SDS یا ماده احیا کننده در SDS-PAGE
رفع مشکل:غلظت SDS یا ماده احیا کننده در بافر نمونه را افزایش دهید یا در صورت امکان نمونه پروتئین را رقیق کنید تا نسبت غلظت آن با SDS و ماده احیا کننده متناسب گردد.
علت: پایین بودن PH نمونه (بخصوص بعد از رسوب با تری کلرو استیک اسید)
رفع مشکل:PH نمونه را تنظیم کرده یا در مقابل بافر مناسب دیالیز کنید. قبل از الکتروفورز، نمونه را در 20/000xg سانتریفیوژ نمایید.
-
مشکل:قرار نگرفتن نمونه در ته چاهک ها
علت: عدم وجود گلیسرول یا ساکارز در بافر نمونه
رفع مشکل: به بافر نمونه گلیسرول یا ساکارز اضافه شود.
-
مشکل: جاری شدن نمونه در چاهک های کناری
علت:بزرگتر بودن ضخامت اسپیسر ها نسبت به ضخامت شانه
رفع مشکل:در هنگام تهیه ژل از شانه مناسب استفاده شود.
علت:سرریز شدن چاهک ها از نمونه
رفع مشکل:حدود 30-50 درصد هر چاهک از نمونه پروتئینی بریزید.
-
مشکل:باندهای نامنظم و مواج
علت: وجود حباب های هوا در ژل
رفع مشکل:محلول ژل را هواگیری نمایید.
علت: ناهمگونی اندازه منافذ ژل
رفع مشکل: محلول ژل را کاملا مخلوط نمایید. مقدار پرسولفات آمونیوم را تنظیم نمایید تا زمان انعقاد ژل متناسب گردد.
علت: لرزش قالب شیشه ای در هنگام انعقاد ژل
رفع مشکل:قالب شیشه ای را فیکس نموده و آن را کنار دستگاه های لرزاننده قرار ندهید.
علت: ادامه پلیمریزاسیون ژل در چاهک ها پس از خارج ساختن شانه
رفع مشکل:پس از انعقاد کامل ژل بالا و خارج نمودن شانه، چاهک ها را با بافر الکترود شستشو دهید.
علت: بالا بودن غلظت نمک در نمونه
رفع مشکل: نمونه را با بافر نمونه (1X) رقیق کرده یا در مقابل بافر مناسب دیالیز نمایید.
علت: عدم تماس کامل ژل با نوارهای کاغذی و یا الکترودهای فلزی
رفع مشکل: لبه نوارهای کاغذی را بطور مساوی روی لبه طولی ژل قرار دهید، سپس الکترودهای فلزی را بطور دقیق روی نوارها قرار دهید.
-
مشکل: وجود ستون های رنگی با باندهای نا مشخص یا کاملا تفکیک نشده
علت:پروتئولیز شدید در هنگام استخراج یا آماده سازی نمونه
رفع مشکل:استخراج نمونه در دمای پایین و در حضور مهار کننده های پروتئیازها صورت گیرد. بعد از افزودن بافر نمونه در SDS-PAGE نمونه را سریعا در آب جوش قرار دهید.
علت:پایین بودن کیفیت SDS
رفع مشکل: SDS با درجه خلوص بالا تهیه شود.
علت: وجود غلظت بالای موادی مثل کلرید گوانیدیوم در نمونه
رفع مشکل:در صورت امکان نمونه را رقیق کنید یا کلرید گوانیدیوم را با ترکیبات سازگار در الکتروفورز (مثل اوره) تعویض کنید.
-
مشکل: خطوط رنگی در مسیر الکتروفورز در ستون ها
علت: حل شدن تدریجی توده های مولکولی موجود در نمونه
رفع مشکل: نمونه را قبل از الکتروفورز به مدت 15 دقیقه در حداقل 20/000xg سانتریفیوژ نمایید.
-
مشکل:وجود باندهای کاذب در تمام ستون ها
علت: وجود باندهای کاذب در تمام ستون ها یا در سراسر عرض ژل
رفع مشکل: اثر 2-ME پس از رنگ آمیزی ژل با نقره (به صورت دو باند منتشره در موقعیت های 50 و 67 کیلو دالتون)
رفع مشکل: به جای 2-ME از دی تیوتریتول استفاده نمایید یا ژل را با روش دیگری رنگ امیزی کنید.
علت: آلوده شدن بافر نمونه
رفع مشکل: بافر تازه تهیه نمایید.
علت: وجود ناخالصی در بافر مخزن بالا
رفع مشکل:از مواد شیمیایی با خلوص و کیفیت بالا برای تهیه بافرها استفاده نمونه، ترجیحا از بافرها مجددا استفاده نکنید.
-
مشکل: عدم تکرار پذیری نتایج الکتروفورز
علت: پروتئولیز نمونه در هنگام استخراج یا نگهداری آن
رفع مشکل: استخراج نمونه در دمای پایین و در حضور مهارکننده های پروتئاز صورت گیرد. نمونه در شرایطی نگهداری شود که دچار حداقل تغییرات گردد.
علت: متناسب نبودن مقدار SDS و یا ماده احیا کننده در بافر نمونه نسبت به پروتئین (در SDS-PAGE)
رفع مشکل: غلظت SDS و یا ماده احیا کننده در بافر نمونه افزایش یابد یا در صورت امکان رقیق گردد.
علت:تغییر در روش یا شرایط رنگ آمیزی
رفع مشکل: ژل ها را با یک روش ثابت و در شرایط یکسان رنگ آمیزی کنید.
-
مشکل: تبلور اوره در ژل
علت: پایین بودن درجه حرارت
رفع مشکل:الکتروفورز در دمای 15 درجه سانتیگراد انجام شود.
-
مشکل: رانش کاتدی پروتئین ها در ایزوالکتروفوکوسینگ
علت: حل شدن گاز کربنیک در بخش قلیایی ژل
رفع مشکل:محلول کاتولیت را هواگیری نموده، از NaOH با درجه خلوص بالا (دارای حداقل ناخالصی کربنات) برای تهیه آن استفاده کنید. از تماس هوا با ژل تا حد امکان خودداری شود. زمان الکتروفورز تا حد امکان کوتاه شود.
علت: الکترواسمز
رفع مشکل: استفاده از اکریل آمید با خلوص بالا در تهیه ژل جذب ترکیبات یونی آزاد با رزین های تعویض کننده یون (مثل آمبرلیت MB-6). افزودن گلیسرول به ژل در غلظت 10-15 درصد
فیلم آموزش انجام تکنیک SDS-PAGE - الکتروفورز عمودی (زبان انگلیسی)
آموزش تئوری تکنیک SDS-PAGE - الکتروفورز عمودی (زبان انگلیسی)
آموزش اصول تکنیک SDS-PAGE - الکتروفورز عمودی (زبان انگلیسی)
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب مشابه :
- اصول PCR و کاربردهای آن، طراحی پرایمر
- دستگاه فرمانتور | بیوراکتور چیست؟
- کامل ترین مجموعه کروماتوگرافی |انواع و روشهای کروماتوگرافی| بیوتکنولوژی
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
- معرفی تجهيزات آزمايشگاهی
- رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامه ها
- رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- آموزش RSM| تحلیل نمودارهای آماری در روش سطح پاسخ | نرم افزار دیزاین اکسپرت

دیدگاهها
سه سئوال از خدمت شما داشتم:
1- در موقع خارج كردن شانه چرا بعضي از چاله ها شكل كج و غير طبيعي پيدا مي كنند؟
2- بعضي از چاله ها با وجوديكه شكل طبيعي دارند و حبابهاي داخل آنها را نيز با بافر تانك خارج مي نماييم باز نمونه به خوبي در كف چاله قرار نمي گيرند؟ گويا جدار چاله به هم چسبيده اند.
3- آيا مي توان فقط از يك بافر استفاده كرد و در داخل دو مخزن داخلي و بيروني فقط بافر تانك ريخت؟
ممنون و سپاسگزارم
متدين
سوال 2 با همین روش مشکل حل میشه . در ضمن چک کنید شانه ژل دارای زبری نباشه.
و سوال سوم اینکه چاهک ها یک نوع بافر داره..معمولا پایین ژل از بافر استفاده شده استفاده میکنن برای صرفه جویی. دلیل خاصی نداره
روش استخراج برای پروتئینهای مرتبط با بیماری زایی در گیاه گندم که با قارچ عامل بیماری تیمار شده است، وجود ماده PMSF ضروری است؟ آیا جایگزینی برای این ماده وود دارد؟
با سپاس فراوان