مطالب مرتبط:
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- بهينهسازي و معرفي انواع مختلف روشهای آن
- توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامهها
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
بهینهسازی فاکتورهای مؤثر در رشد باکتری Escherichia coli تولیدکننده پروتئین نوترکیب βNGF با استفاده از روش سطح پاسخ
| نوع مقاله: کامل پژوهشی | |
| نویسندگان | |
| 1دانشجوی کارشناسی ارشد از بخش زیست فناوری میکروبی دانشگاه تهران | |
| 2هیات علمی دانشگاه تهران | |
| 3دانشجوی کارشناسی ارشد دانشکده علوم و فنون نوین دانشگاه تهران | |
| 4استادیار بخش زیست فناوری میکروبی دانشگاه تهران |
چکیده
تولید پروتئینهای نوترکیب در میزبان باکتریایی ای کلای در چند دهه اخیر بسیار رواج پیداکرده است. مطالعات و آزمایشهای بسیار زیادی در زمینه بهینهسازی و افزایش تولید و بیان پروتئینهای نوترکیب در این میزبان انجامگرفته است. از راههای افزایش تولید، رسیدن به تراکم بالای سلولی (افزایش غلظت سلولی) و به طبع آن تولید بیشتر پروتئینهای داخل سلولی ازجمله پروتئین نوترکیب –NGF βمیباشد. بدین منظور در این پژوهش برای اولین بار با استفاده از گلیسرول و عصاره مخمر بهعنوان منابع کربن و نیتروژن و همچنین نمک MgCl2 به عنوان افزایش دهنده رشد، کشت باکتری در تراکم سلولی بالا انجام شد. همچنین تأثیر شرایط کشت شبانه بر رشد باکتری مورد بررسی قرار گرفت. بهینه شرایط با استفاده از روش سطح پاسخ به دست آمد که شامل غلظت 18/23 گرم بر لیتر گلیسرول، غلظت 14/44 گرم بر لیتر عصاره مخمر و غلظت mM 10 نمک MgCl2 میباشد. همچنین کشت 14 ساعته در دمای 37 درجه سانتی گراد و دور شیکرrpm 180 به عنوان شرایط بهینه رشد معرفی شد. اﯾﻦ ﻣﻄﺎﻟﻌﻪ ﻧﺸﺎن داد ﮐﻪ میزان رشد سلولی و ﺗﻮﻟﯿﺪ پروتئین نوترکیب –NGF β در ﺷﺮاﯾﻂ بهینهشده ﻧﺴﺒﺖ ﺑﻪ ﻣﺤﯿﻂ ﮐﺸﺖ ﭘﺎﯾﻪ اﻓﺰاﯾﺶ قابلتوجهی داﺷﺘﻪ اﺳﺖ.
کلمات کلیدی: گلیسرول، عصاره مخمر، روش سطح پاسخ، کشت شبانه، MgCl2
Optimization of the effective factors in E.coli growth producing recombinant β-NGF using response surface methodology
ABSTRACT
Production of recombinant proteins in Escherichia coli has been very common in recent decades. Many studies and experiments have been done in order to optimize the production and expression of recombinant proteins in E.coli. One strategy is using high cell density to increase recombinant protein production such as β-NGF in the cell. Therefore, in this study for the first time bacterial cell culture in high cell density was done using glycerol and yeast extract as carbon and nitrogen sources and MgCl2 as a growth effective factor. Also the effects of overnight culture conditions on bacterial growth were evaluated. Meanwhile culture conditions were optimized using response surface methodology (RSM) and the optimum conditions were as follows: 18/23 g/lit glycerol, 14.44 g/lit yeast extract and 10mM MgCl2. Also the obtained results indicated that the 14 hours incubation at 37 °C and 180 rpm were optimum conditions for the overnight culture. Our results showed that the rate of cell growth and recombinant β-NGF production in optimized condition is significantly higher than in basic medium.
Keywords: glycerol, yeast extract, MgCl2, response surface methodology (RSM), overnight culture
مقدمه
فاكتور رشد عصبي (Nerve Growth Factor) 50 سال قبل بهعنوان پروتئيني كه قابليت تمايز[1]، بقا، رشد و حفاظت از سلولهای عصبي مركزي و محيطي را دارد و همچنین بهعنوان شناختهشدهترین عضو خانواده نوروتروفين ها[2]، شناسايي شد. بهعلاوه اين پروتئين يك هورمون (با مثالهایی از فعالیتهای اتوكريني[3] روي سلولهای B) نيز بهحساب میآید كه اثرگذاري آن را روي سلولهاي غیرعصبی نشان میدهد[1]. غدد بزاقی موش نر بالغ بهعنوان یکی از منابع طبیعی غنی از NGF شناختهشده که شباهت زیادی به NGF انسانی دارد[2].
ثابتشده است پروتئین NGF در مدلهای حیوانی با بیماریهای تخریب عصبی، روند تخریب نورونها را کاهش داده یا از بین میبرد .[3] همچنین این پروتئین تولید اعصاب محیطی در موش صحرایی را تقویت کرده و باعث بازگشت حافظهی تخریبشدهی موشهای صحرایی پیر میشود.[4,5] بهعلاوه این پروتئین عملکرد حافظهی تخریب شدهی موشهای صحرایی جوان بالغ را نیز بهبود میبخشد .[6] پروتئینNGF در درمان التهاب ناشی از بیماریهای خود ایمن مغزی مثل مالتیپل اسکلروزیس[4] از طریق بازسازی غلاف میلینی اطراف اکسون ها ایفای نقش میکند.[7] مهمترین عملکرد NGF در تمایز سلولهای بنیادی نورونی و در درمان بیماریهای عصبی مثل آلزایمر[5] است [8]. علاوه بر ایفای نقش در تمایز سلولهای عصبی این پروتئین نقشهای ثانویهی دیگری نیز دارد که از میان آنها میتوان به التیام بخشیدن زخمها در موشهای سالم و مبتلا به دیابت و درمان بیماریهای مربوط به قرنیهی چشم اشاره کرد [9,10].
با توجه به عملکرد فاکتورهای رشد متعلق به خانوادهی نوروتروفینها مثلNGF بر روی تکثیر، تمایز، بقا و مرگ سلولهای عصبی و با توجه به این مسئله که به دست آوردن مقادیر زیادی از این پروتئین از منابع طبیعیاش کار مشکل، زمانبر و پرهزینهای است، توجه محققان به سمت تولید نوترکیب این پروتئین در میزبانهای مختلف معطوف شد[11] .
کاربرد بسیار گسترده، سرعت و بازده بالای بیان، سیستمهای متنوع برای بیان پروتئینهای نوترکیب، ژنتیک شناختهشده، نرخ رشد بالا، کشت ارزان و امکان دست ورزی آسان، بهعنوان اصلیترین مزیت E.coli برای بیان پروتئینهای نوترکیب شناختهشده است[12].
تعدادی از عوامل تأثیرگذار در بازده نهایی تولید پروتئین نوترکیب، ترکیب محیط کشت، زمان القاء پروموتر و تولید اسید استیک میباشد. کشت باکتری E.coli در تراکم سلولی بالا در شیک فلاسک با استفاده از محیطها و غلظتهای مختلف IPTG[6] برای تولید پروتئینهای متنوعی گزارششده است[13].
ترکیبات محیط کشت سلول باید بهدقت فرموله شده و تحت نظارت باشد، زیرا ممکن است اثرات متابولیکی قابلتوجهی همروی رشد سلول و هم در تولید پروتئین داشته باشد[14]. بنابراین، هدف از این مطالعه بهینهسازی محیط کشت بهمنظور دستیابی به رشد سلولی بیشتر و بیان بالاتر پروتئین نوترکیب β-NGF در میزبان BL21(DE3) E.coli میباشد.
2-مواد و روشها
تهیهی محیط کشت
از محیط LB broth به همراه 1% کانامایسین به عنوان محیط کشت پایه استفاده شد. محیط کشت تهیه شده برای رشد باکتری ها، شامل گلیسرول بهعنوان منبع کربن (شرکت biobasic) و عصارهی مخمر بهعنوان منبع نیتروژن (شرکتQUELAB) است که با استفاده از روش سطح پاسخ(RSM)[7] غلظتهای این دو منبع بررسی شدند. همچنین به هریک از غلظتها 5g/l NaCl و 10 mM MgCl2(ضروری برای رشد در ترکم سلولی بالا) افزوده و با استفاده از آب مقطر به حجم رسانده شدند. در پایان pH همه نمونهها بین 7/6-7/4 تنظیم گردید.
سویهی باکتری و وکتور pET39b(+)
در این پژوهش از سویهی BL21(DE3) E.coli (میزبان باکتریایی) ترانسفورم شده با وکتور pET39b(+) (ناقل بیانی) خریداریشده از شرکت Nova gene آمریکا استفاده شد.
شرایط کشت شبانه
بهمنظور تهیه کشت شبانه یک کلونی تک به محیط کشت LB تلقیح شد و سوسپانسیونی تهیه و به تمامی نمونهها مقدار یکسانی تلقیح شد. بهمنظور بررسی تأثیر مدتزمان و شرایط کشت شبانه بر رشد سلولی، کشت شبانه در زمانها (10، 12، 14، 16 ساعت) و شرایط مختلف (دور شیکر 150 و rpm 180 - دمای 25 و 37 درجه سانتی گراد) انجام گرفت.
بررسی رشد (تراکم سلولی[8])
تمامی آزمایشها در ارلن های 100 میلیلیتری حاوی 20 میلیلیتر محیط کشت انجام شدند. به هر محیط کشت 1% حجمی حجمی تلقیح از کشت شبانه صورت گرفت و نمونهها در شیکر انکوباتور با دمای 37 درجه و دور شیکرrpm 180 قرار داده شدند. بهمنظور بررسی رشد، در فواصل زمانی معین جذب تمامی نمونهها در طولموج nm600 بهوسیله دستگاه UV-Vis Spectrophotometer ( Thermoساخت آمریکا ) قرائت شد و نمودار رشد آنها رسم گردید.
ﻃﺮاﺣﯽ آزﻣﺎﯾﺶ CCD[9]
در این پژوهش برای طراحی آزمایشها و بهینهسازی میزان منابع کربن و نیتروژن محیط، از طراحی آزمایش به روش سطح پاسخ (RSM) توسط نرمافزار (Statease, USA)0/7 DESIGN EXPERT استفاده شد. همچنین با استفاده از ﻣﻨﺤﻨﯽ ﺑﺮﺟﺴﺘﻪ، برهمکنش دو ﻣﺘﻐﯿﺮ بر روي ﭘﺎﺳﺦ ﻣﺸﺨﺺ ﺷﺪ.
جهت دریافت مشاوره تخصصی انجام طراحی آزمایش (RSM) به منوی خدمات ما مراجعه فرمایید.
بیان پروتئین نوترکیب β-NGF انسانی در سویهی باکتریایی BL21(DE3) و تأیید آن با استفاده از تکنیک دات بلات[10]
میزان %1 از کشت شبانهی سویهی BL21(DE3) E.coli دارای وکتور pET39b::βNGF بهصورت جداگانه در محیط LB و محیط کشت بهینهشده توسط روش سطح پاسخ حاوی آنتیبیوتیک کانامایسین در دمای 37 درجه سانتیگراد کشت داده شد. پس از رسیدن OD به 6/0 در طولموج 600 نانومتر القا توسط1 میلی مولار IPTG صورت گرفت و پس از اتمام مدتزمان بیان، سلولها در دمای 4 درجه سانتیگراد سانتریفیوژ و جمعآوری شدند. سپس کل محتوای پروتئینی تولیدشده توسط افزودن اوره 8 مولار (شرکت Merck آلمان) استخراج گردید. نمونههای پروتئینی استخراجشده روی کاغذ نیترو سلولز (شرکت Millipore آمریکا) لکهگذاری شدند و کاغذ توسط بافر بلوکه کنندهی TBS-T (Tris-HCl, NaCl, Tween20) بلوکه شد. پس از انجام سه مرحله شستشو با بافر TBS-T، آنتیبادی مونوکلونال ضد His-tag متصل به آنزیم HRP[11] (شرکت Sigma آمریکا) با رقت 1:1000 مورداستفاده قرار گرفت. در پایان، کاغذ با سوبسترای رنگی DAB (شرکت Biobasic کانادا) در حضور پر اکسید هیدروژن بهعنوان سوبسترای آنزیم در محیط تاریک انکوبه شد.
3 - نتایج
3-1 ﺗﺤﻠﯿﻞ دادههای ﺣﺎﺻﻞ از بهینهسازی شرایط کشت شبانه
مدتزمان، دما و دور شیکر کشت شبانه در میزان رشد سلولی کشت اصلی مؤثر میباشد. نمودار رشد باکتری با تأثیر این عوامل رسم گردید (شکل 1).
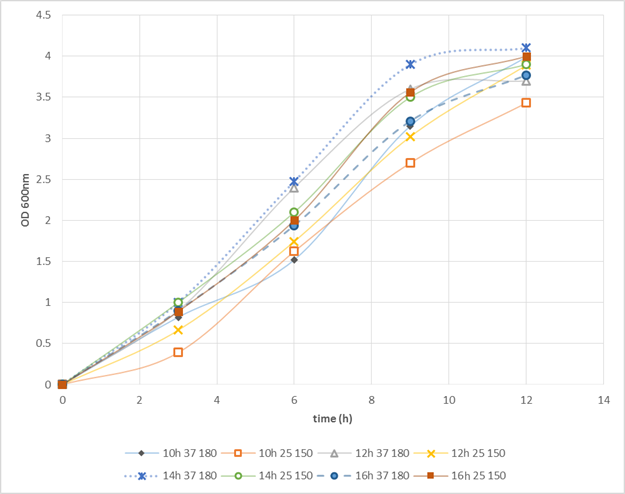
شکل 1- نمودار رشد باکتریها با شرایط کشت شبانه متفاوت (نتایج حاصل سه بار تکرار میباشد). نمودارها نشان دهنده تأثیر زمانهای کشت (10، 12، 14، 16 ساعت)، دما (25، 37 درجه سانتی گراد) و دور شیکر متفاوت (150 و 18 rpm) بر منحنی رشد باکتری ها می باشد.
همانطور که ملاحظه میشود نتایج نشان میدهد که کشت 14 ساعته در دمای 37 درجه و دور شیکر 180rpm ازنقطهنظر رشد سریعتر و تراکم سلولی بالاتر[12] (OD max) بهترین شرایط برای ادامه کار میباشد.
3-2 تأثیر MgCl2 بر رشد باکتری
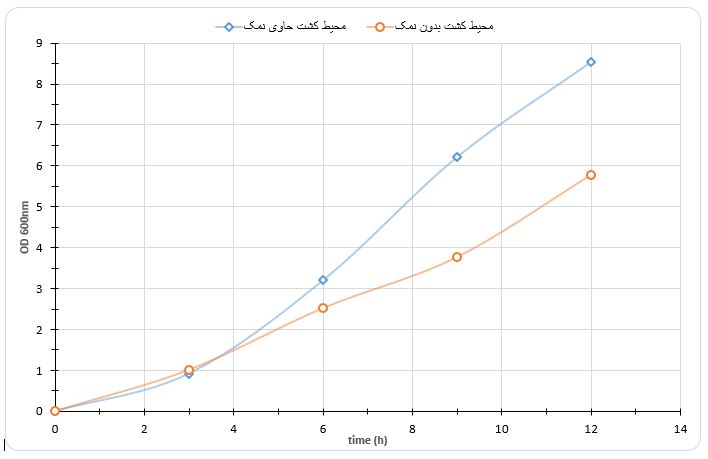
وجود نمک MgCl2 برای رشد باکتری در تراکم بالا ضروری است. بهمنظور تأیید این ادعا، دو محیط کشت بهصورت جداگانه شامل محیط کشت بهینه کامل و محیط کشت بهینه فاقد نمک تهیه و باکتری به آن تلقیح شد. نمودار رشد باکتریها رسم گردید (شکل 2).
شکل2- منحنی رشد باکتری، در حضور و عدم حضور غلظت mM 10 نمک MgCl2 .
همانطور که از شکل مشاهده میشود رشد باکتریها در حضور غلظت mM 10نمک MgCl2 بهویژه بعد از 4 ساعت نسبت به حالتیکه نمک به محیط افزوده نشده است، بسیار سریعتر انجام میشود. لذا در بقیه مراحل کار MgCl2 با غلظت mM 10 به محیط کشت باکتریها افزوده شد.
3-3 ﺗﺤﻠﯿﻞ دادههای ﺣﺎﺻﻞ از بهینهسازی ﻣﺤﯿﻂ ﮐﺸﺖ ﺑﻪ روش RSM
از عوامل مؤثر در تولید کشت با تراکم سلولی بالا در E.coli، غلظت عصاره مخمر و گلیسرول (منبع کربن و نیتروژن) بوده که بهعنوان فاکتورهای اصلی برای بهینهسازی انتخاب شدند و آزمایشها مطابق روش CCD سطح پاسخ برای این دو عامل در قالب 13 آزمایش با 5 نقطه مرکزی طراحی شد.
اثر هر دو متغیر و اثرات متقابل آنها بر روی پاسخ از طریق انجام آزمایشها در 5 سطح مختلف و بهصورت غیر تصادفی برای هر دو متغیر مورد مطالعه قرار گرفتند. مقدار تراکم سلولی بالا(جذب nm600) بهعنوان پاسخ به کمک نرمافزار0/7 DESIGN EXPERT آنالیز شد( جدول 1).
جدول 1-آنالیز انحراف معیار تراکم سلولی بالا.
|
ﻋﺒﺎرت |
ﻣﺠﻤﻮع |
ﻣﺮﺑﻊ |
F-Value |
P-Value |
|
ﻣﺮﺑﻌﺎت |
ﻣﯿﺎﻧﮕﯿﻦ |
Probe>F |
||
|
|
|
|
||
|
A |
65/28 |
65/28 |
62/101 |
0001/0 |
|
B |
19/3 |
19/3 |
32/11 |
0099/0 |
|
A2 |
67/3 |
67/3 |
02/13 |
0069/0 |
|
B2 |
77/0 |
77/0 |
66/3 |
0971/0 |
|
AB |
02/2 |
02/2 |
15/7 |
0282/0 |
مقدار p-Value ﺑﺮاي ﺗﺮمﻫﺎي ﻏﻠﻈﺖ عصاره مخمر(A)، غلظت گلیسرول(B) و ﺗﻮان دوم ﻏﻠﻈﺖ عصاره مخمر (A2) و حاصلضرب غلظت عصاره مخمر در غلظت گلیسرول (AB) ﮐﻤﺘﺮ از 05/0 اﺳﺖ درنتیجه اهمیت این ترمها در ﺗﻮﻟﯿﺪ ﺑﻬﯿﻨﻪ تراکم سلولی، قابلملاحظه اﺳﺖ. ﺗﺮم B2 ﺑﺎ ﻣﻘﺪار ﺑﺎﻻﺗﺮ از 05/0 ﺗﻮﺳﻂ نرمافزار ﺣﺬف میشود. همچنین ﻣﻘﺪار (R2)=0/9628 R-Squared (ضریب تشخیص[13]) ﺑﺮاي ﻣﻌﺎدﻟﻪ بهدستآمده، نشاندهنده ﻫﻤﭙﻮﺷﺎﻧﯽ ﻣﻨﺎﺳﺐ دادههای آزﻣﺎﯾﺸﮕﺎﻫﯽ و ﻣﻘﺎدﯾﺮ پیشبینیشده ﺗﻮﺳﻂ ﻣﺪل ارائهشده برای ﺗﻮﻟﯿﺪ ﺑﻬﯿﻨﻪ ﺗﻮده زﯾﺴﺘﯽ است.
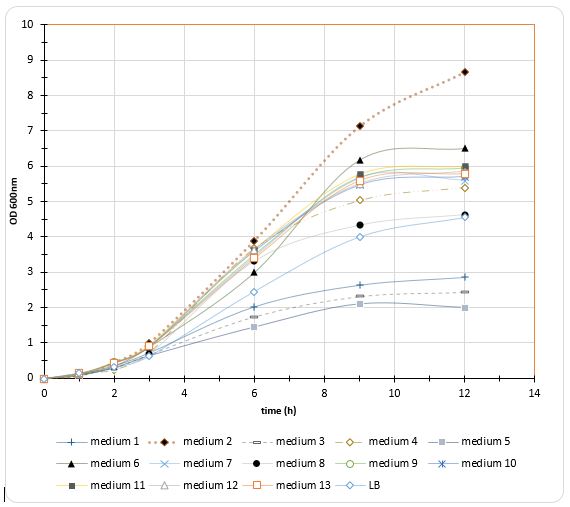
نتایج رشد سلول های باکتری در محیط های کشت تهیه شده، نشان میدهند که با افزایش غلظت نیتروژن (عصاره مخمر) تا 14/44 گرم در لیتر تراکم سلولی افزایش مییابد و پسازآن افزایش غلظت تأثیری بر سرعت رشد ندارد، اما با بالا بردن میزان غلظت کربن (بیشتر از 18/23 گرم بر لیتر) تراکم سلولی کاهش مییابد. همانطور که مشاهده میشود بیشترین میزان رشد در غلظت 14/44 گرم در لیتر عصاره مخمر و 18/23 گرم در لیتر گلیسرول دیده میشود (شکل3 و 4).
شکل3-منحنی رشد باکتریها در محیط کشتهای حاوی مقادیر متفاوت گلیسرول و عصاره مخمر(نتایج حاصل سه بار تکرار میباشد).
جهت دریافت مشاوره تخصصی انجام طراحی آزمایش (RSM) به منوی خدمات ما مراجعه فرمایید.
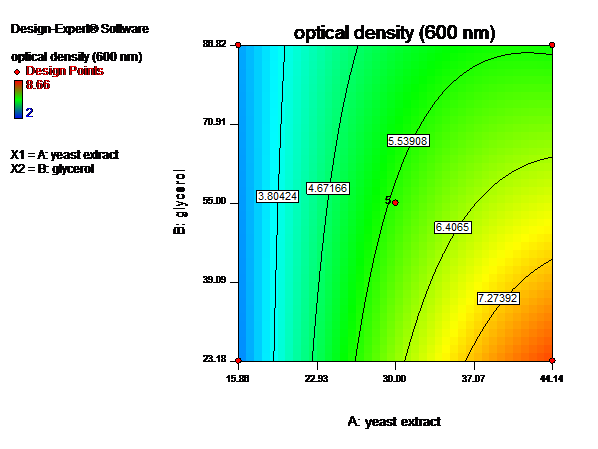
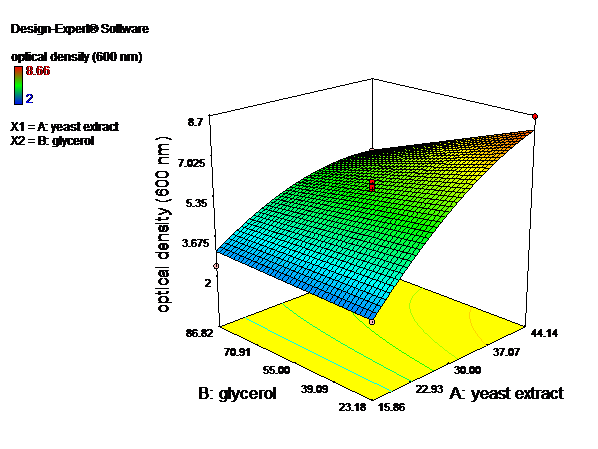
شکل4- الف.ﻧﻤﺎﯾﺶ دوبعدی تأثیر غلظتهای عصاره مخمر و گلیسرول ﺑﺮ ﻣﯿﺰان چگالی نوری(تراکم سلولی).ب.ﻧﻤﺎﯾﺶ سهبعدی تأثیر غلظتهای عصاره مخمر و گلیسرول ﺑﺮ ﻣﯿﺰان چگالی نوری.
3-3- بررسی بیان
سویه باکتری BL21(DE3) که با وکتور pET39b::hNGFترانسفورم شده است در غلظت 18/23 گرم در لیتر گلیسرول و 14/44 گرم در لیتر عصاره مخمر وmM10 نمک MgCl2 کشت داده شد. از کشت باکتری در محیط LB نیز بهعنوان کنترل استفاده گردید.
با استفاده از تکنیک دات بلات صحت بیان ارزیابی شد (شکل 5). ظهور لکه در هر دو نمونه نشاندهنده واکنش آنتیبادی ضد his-tag با پروتئین NGF تولیدشده (حاوی دنباله پلی هیستیدین) میباشد. با مقایسه شدت رنگ لکهها میتوان بهصورت تقریبی چنین استنباط کرد که میزان بیان در نمونههای کشت دادهشده در محیط بهینهشده بیشتر از نمونههای کشت دادهشده در محیط LB میباشد.

شکل5 - نتیجه آزمایش دات بلات با استفاده از آنتیبادی مونوکلونال ضد his-tag. نمونه 1 پروتئینهای استخراجشده از باکتریهای کشت دادهشده در محیط LB برات (نمونه کنترل) و نمونه 2 پروتئینهای استخراجشده از باکتریهای کشت دادهشده در محیط کشت بهینه.
بحث
تا سال 1982 که برای اولین بار انسولین انسانی نوترکیب با استفاده از باکتری E.Coli به تولید رسید، تنها منبع تولید پروتئینهای دارویی ازجمله فاکتورهای رشد و پروتئینهای خونی مختلف، منابع طبیعی آنها نظیر خون یا بافتهای حیوانی بود. پسازآن نیز تولید نوترکیب پروتئینهای دارویی قابلتولید، اغلب به میزان بسیار اندک و با هزینه بسیار بالایی انجام میشد. [15]
بهینهسازی شرایط رشد، تولید پروتئینهای نوترکیب در E.coli را به میزان قابلتوجهی افزایش خواهد داد که از آن جمله میتوان به استفاده از سیستمهای کشت سلولی با چگالی بالا که میتواند غلظت سلول را به بیش از 100 گرم ماده خشک در یک لیتر برساند اشاره کرد. همچنین مطالعات متعددی در مورد سیستمهای تخمیر انجامشده است که نشان میدهند ترکیب مواد مغذی و متغیرهای تخمیر مانند دما و pH میتواند در ترجمه mRNA، فعالیت پروتئولیتیک، ترشح و سطح تولید پروتئین نوترکیب تأثیرگذار باشند[16]. دستکاریهای خاصی در محیط کشت بهمنظور ارتقاء انتشار پروتئین به محیط بیرون بدون ایجاد لیز سلولی نیز انجامشده است. بااینوجود، سیستمهای کشت سلولی با چگالی بالا از اشکالات متعددی ازجمله: در دسترس بودن محدود اکسیژن محلول در تراکم سلولی بالا و سطح بالای دیاکسید کربن که میتواند باعث کاهش نرخ رشد و تحریک تشکیل استات شود برخوردار میباشند.[17-18]
چاپرون ها ترکیبات شیمیایی با وزن مولکولی کم هستند، ازجمله گلیسرول، که برای جلوگیری از تشکیل تجمع اینکلوژن بادیها در طول فولدینگ درآزمایشگاه استفاده میشوند. گلیسرول با توجه به گسترش تعاملات آبگریز میتواند بهعنوان تثبیتکننده واسطههای فولدینگ پروتئین، عمل کند[19-20]. در یک گزارش از Savari و همکاران اثرات چاپرونهای شیمیایی مانند گلیسرول و اتانول در تولید هورمون رشد نوترکیب در محلول مورد بررسی قرارگرفته است که نتایج آن تأیید میکنند که گلیسرول باعث افزایش حلالیت پروتئین نوترکیب هورمون رشد در E.coli شده است.[21] بهتازگی، مطالعات آزمایشگاهی در سلولهای ترانسفکت شده نشان داده است که گلیسرول میتواند فولدینگ اشتباه دلتا F508 CFTR در سیستیک فایبروزیس را از طریق ایجاد یک واسطه، تصحیح کند [22].
به علاوه گلیسرول چاپرون شیمیایی است که به عنوان عنصر حفاظتی برای پروتئین در برابر دناتوره شدن توسط افزایش هیدراتاسیون نسبی در اطراف پروتئین عمل می کند. در مطالعه Leandro و همکارن نشان داده شده است که گلیسرول به عنوان یک مراقب شیمیایی باعث افزایش تولید و عملکرد آنزیم موتانت فنیل آلانین هیدروکسیلاز میشود [20]. در تحقیقات Lin و همچنین Cao و همکاران نشان داده شده است که گلیسرول با توجه به اثراتش بر سوختوساز سلول به عنوان منبع کربن نیز استفاده میشود .[23-24]
گزارشهای بسیاری نیزنشان میدهد که عصاره مخمر اغلب بهعنوان منبع ازت اضافی برای بهبود بیان پروتئینهای نوترکیب مورداستفاده قرارگرفته است [25-26] که البته با توجه به غنی بودن، بهعنوان منبع کربن نیز در نظر گرفته میشود .[24]
بهعلاوه افزودن نمکهایی چون MgCl2 به محیط کشت نیز بیتأثیر نمیباشد بطوریکه سلولهای باکتری در عدم حضور MgCl2 رشد کندتری دارند و برای رسیدن به تراکم سلولی بالا افزودن یون منیزیوم ضروری می باشد. علاوه بر این، در مطالعه ایکه در سال 2014 توسط Nierhaus انجام شد به نقش بسیار موثر یون منیزیوم در پروتئین سازی اشاره شده است. در این مطالعه نشان داده شد که در محیطی که تنها یون منیزیوم حضور دارد، در غلظت های پایین تر ازmM 10 از یون Mg+2 ریبوزوم ها غیر فعال خواهند شد [27]. لذا در مطالعه حاضر، با توجه به حضور یون ها و نمکهای دیگری در محیط (بطور مثال NaCl) تأثیر یون منیزیوم بر رشد مورد بررسی قرار گرفت، و از همان غلظت مورد اشاره در مقالات یعنی 10 میلی مولار استفاده گردید.
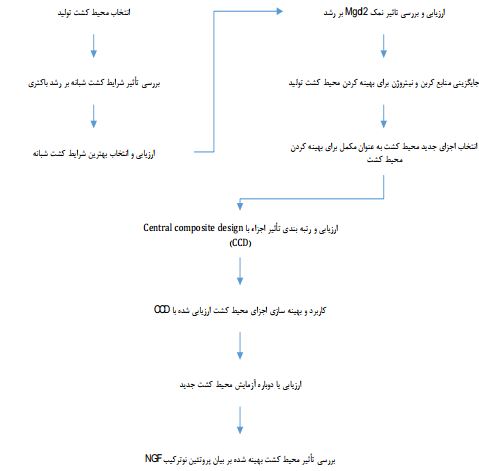
بنابراین در این پژوهش پس از بررسی میزان تأثیر یون منیزیوم، از عصاره مخمر به عنوان منبع اصلی نیتروژن اضافی و از گلیسرول به عنوان منبع کربن و چاپرون شیمیایی برای بهبود فولدینگ پروتئین استفاده شد. لازم به ذکر است که کل مراحل انجام کار در این پژوهش در فلوچارت ترسیمشده در شکل 6 به نمایش گذاشته شده است.
شکل6- فلو چارت مراحل انجام کار در این پژوهش.
نتایج بررسی حاضر نشان داد که با افزایش غلظت کربن تا 18/23 گرم بر لیتر رشد افزایش مییابد اما پسازآن افزایش غلظت منبع کربنی اثر مهاری بر رشد دارد. این نتایج با نتایج بهدستآمده توسط دانشمندان دیگر نیز مطابقت دارد .[28-29] از طرف دیگر، با افزایش غلظت عصاره مخمر تا 14/44 گرم بر لیتر رشد افزایش مییابد و پسازآن افزایش بیشتر غلظت عصاره مخمر تأثیری بر روی رشد باکتریها ندارد که این نتیجه در تحقیقات Yang و همکاران نیز بهدستآمده بود. [30]
بنابراین بهترین شرایط محیط کشت غلظت 18/23 گرم بر لیتر گلیسرول، غلظت 14/44 گرم بر لیتر عصاره مخمر و غلظت mM 10 نمک MgCl2 و 5 گرم بر لیتر NaCl میباشد که برای بیان پروتئین βNGF از آن استفاده شد. نتایج دات بلات با استفاده از آنتیبادی ضد his-tag تولید به میزان قابل قبولی را در نمونههای کشت دادهشده در محیط بهینه نشان داد. شایانذکر است که بهمنظور تأیید دقیقتر میزان تولید پروتئین تولیدی مراحل خالصسازی و تعیین غلظت پروتئین الزامی میباشد.
تشکر و قدردانی:
تحقیق حاضر با حمایت مالی ستاد توسعه و علوم سلولهای بنیادی تحت شماره طرح 25802/11 به دکتر زهرا حاجی حسن انجامشده است. همچنین نویسندگان از دانشگاه تهران به دلیل حمایت مالی بهمنظور انجام این پروژه تشکر و قدردانی مینمایند.
منابع:
- Levi‐Montalcini, R. (1987) the nerve growth factor: 35 years later (Nobel lecture), Angewandte Chemie International Edition in English 26, 707-716.
- Bax, B., Ferguson, G., Blaber, M., Sternberg, M. J., and Walls, P. H. (1993) Prediction of the three‐dimensional structures of the nerve growth factor and epidermal growth factor binding proteins (kallikreins) and an hypothetical structure of the high molecular weight complex of epidermal growth factor with its binding protein, Protein Science 2, 1229-1241.
- Sahdev, S., Khattar, S. K., and Saini, K. S. (2008) Production of active eukaryotic proteins through bacterial expression systems: a review of the existing biotechnology strategies, Molecular and cellular biochemistry 307, 249-264.
- Sun, W., Sun, C., Lin, H., Zhao, H., Wang, J., Ma, H., Chen, B., Xiao, Z., and Dai, J. (2009) The effect of collagen-binding NGF-β on the promotion of sciatic nerve regeneration in a rat sciatic nerve crush injury model, Biomaterials 30, 4649-4656.
- Fischer, W., Sirevaag, A., Wiegand, S. J., Lindsay, R. M., and Björklund, A. (1994) Reversal of spatial memory impairments in aged rats by nerve growth factor and neurotrophins 3 and 4/5 but not by brain-derived neurotrophic factor, Proceedings of the National Academy of Sciences 91, 8607-8611.
- Jakubowska-Doğru, E., and Gümüşbaş, U. (2005) chronic intracerebroventricular NGF administration improves working memory in young adult memory deficient rats, Neuroscience letters 382, 45-50.
- Althaus, H. H. (2004) Remyelination in multiple sclerosis: a new role for neurotrophins?, Progress in brain research 146, 415-432.
- Heese, K., Low, J. W., and Inoue, N. (2006) Nerve growth factor, neural stem cells and Alzheimer’s disease, Neurosignals 15, 1-12.
- Kawamoto, K., and Matsuda, H. (2004) Nerve growth factor and wound healing, Progress in brain research 146, 369-384.
- Lambiase, A., Sacchetti, M., and Bonini, S. (2012) Nerve growth factor therapy for corneal disease, Current opinion in ophthalmology 23, 296-302.
- Bruce, G., and Heinrich, G. (1989) Production and characterization of biologically active recombinant human nerve growth factor, Neurobiology of aging 10, 89-94.
- Sahdev, S., Khattar, S. K., and Saini, K. S. (2008) Production of active eukaryotic proteins through bacterial expression systems: a review of the existing biotechnology strategies, Molecular and cellular biochemistry 307, 249-264.
- Wang, H., Xiao, Y., Fu, L., Zhao, H., Zhang, Y., Wan, X., Qin, Y., Huang, Y., Gao, H., and Li, X. (2010) High-level expression and purification of soluble recombinant FGF21 protein by SUMO fusion in Escherichia coli, BMC biotechnology 10, 14.
- Sarduy, E. S., Muñoz, A. C., Trejo, S. A., and Planes, M. d. l. A. C. (2012) High-level expression of Falcipain-2 in Escherichia coli by codon optimization and auto-induction, Protein expression and purification 83, 59-69.
- Williams, D. C., Van Frank, R. M., Muth, W. L., and Burnett, J. P. (1982) Cytoplasmic inclusion bodies in Escherichia coli producing biosynthetic human insulin proteins, Science 215, 687-689.
- Lee, S. Y. (1996) Plastic bacteria? Progress and prospects for polyhydroxyalkanoate production in bacteria, Trends in Biotechnology 14, 431-438.
- Yee, L., and Blanch, H. (1992) Recombinant protein expression in high cell density fed-batch cultures of Escherichia coli, Nature Biotechnology 10, 1550-1556.
- Kramer, W., Elmecker, G., Weik, R., Mattanovich, D., and Bayer, K. (1996) Kinetic Studies for the Optimization of Recombinant Protein Formationa, Annals of the New York Academy of Sciences 782, 323-333.
- Alibolandi, M., and Mirzahoseini, H. (2011) Chemical assistance in refolding of bacterial inclusion bodies, Biochemistry research international 2011.
- Leandro, P., Lechner, M. C., de Almeida, I. T., and Konecki, D. (2001) Glycerol increases the yield and activity of human phenylalanine hydroxylase mutant enzymes produced in a prokaryotic expression system, Molecular genetics and metabolism 73, 173-178.
- Savari, M., Esfahani, S. H. Z., Edalati, M., and Biria, D. (2015) Optimizing conditions for production of high levels of soluble recombinant human growth hormone using Taguchi method, Protein expression and purification 114, 128-135.
- Sato, S., Ward, C. L., Krouse, M. E., Wine, J. J., and Kopito, R. R. (1996) Glycerol reverses the misfolding phenotype of the most common cystic fibrosis mutation, Journal of Biological Chemistry 271, 635-638.
- Lin, E. (1976) Glycerol dissimilation and its regulation in bacteria, Annual Reviews in Microbiology 30, 535-578.
- Cao, W., Li, H., Zhang, J., Li, D., Acheampong, D. O., Chen, Z., and Wang, M. (2013) Periplasmic expression optimization of VEGFR2 D3 adopting response surface methodology: Antiangiogenic activity study, Protein expression and purification 90, 55-66.
- Shin, C. S., Hong, M. S., Bae, C. S., and Lee, J. (1997) Enhanced production of human mini‐proinsulin in fed‐batch cultures at high cell density of Escherichia coli BL21 (DE3)[pET‐3aT2M2], Biotechnology progress 13, 249-257.
- Lee, C., Sun, W., Burgess, B., Junker, B., Reddy, J., Buckland, B., and Greasham, R. (1997) Process optimization for large-scale production of TGF-α-PE40 in recombinant Escherichia coli: effect of medium composition and induction timing on protein expression, Journal of Industrial Microbiology and Biotechnology 18, 260-266.
- Nierhaus, KH. (2014) Mg2+, K+, and the Ribosome, Journal of Bacteriology 196, 3817–3819.
- جابری انصاری ف، حاجی حسن ز، جلیلی ح. (2015) تولید پروتئین نوترکیب β-NGF در باکتری اشریشیاکلی با استفاده از شیره خرما، زیستفناوری دانشگاه تربیت مدرس 6, 60-70.
- Vuillemin, M., Malbert, Y., Laguerre, S., Remaud-Siméon, M., and Moulis, C. (2014) Optimizing the production of an α-(1→2) branching sucrase in Escherichia coli using statistical design, Applied microbiology and biotechnology 98, 5173-5184.
- Yang, Y., Zhang, D., Liu, S., Jia, D., Du, G., and Chen, J. (2012) Expression and fermentation optimization of oxidized polyvinyl alcohol hydrolase in E. coli, Journal of industrial microbiology & biotechnology 39, 99-104.
[1] Differentiation
[2] Neurotrophins
[3] autocrine
[4] Multiple Sclerosis
[5] Alzheimer's Disease
[6] Isopropyl β-D-1-thiogalactopyranoside
[7] response surface methodology (RSM)
[8] cell density
[9] central composite design
[10] Dot blot
[11] Horse Radish Peroxidase
[12] High cell-density
[13] Coefficient of Determination
جهت دریافت مشاوره تخصصی انجام طراحی آزمایش (RSM) به منوی خدمات ما مراجعه فرمایید.
برای اطلاعات بیشتر با ما تماس بگیرید.
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب تصادفی: