بیماری آلزایمر Alzheimer's disease
مقدمه
بیماری آلزایمر ، دمانس یا زوال عقل پیری از نوع آلزایمر ، شایع ترین شکل زوال عقلی است. این بیماری علاج ناپذیر ، تحلیل برنده و مرگ آور را برای اولین بار روانپزشک و آسیب شناس عصب آلمانی آلوئیز آلزایمر در سال 1906 معرفی کرد و این نام از او گرفته شد(بیماری آلزایمر به نام ایشان ثبت شده است). غالبا این بیماری در افراد بالای 65 سال بروز می کند ، هر چند آلزایمر زود هنگام با شیوع کمتر می تواند بسیار زودتر از این سن رخ دهد. در سال 2006 میلادی ، 26 میلیون نفر در جهان به این بیماری مبتلا بودند و پیش بینی می شود که تا سال 2050 میلادی از هر 85 نفر یک نفر مبتلا به آلزایمر وجود داشته باشد.
بیماری آلزایمر یک بیماری پیش رونده ، تحلیل برنده ی برنده ی مغز بوده که باعث مختل شدن شدید فکر و حافظه می شود. بیماری آلزایمر شایعترین شکل دمانس یا زوال عقل می باشد.(دمانس یک سندرم متشکل از تعدادی علایم است که از دست دادن حافظه ، قضاوت و استدلال و تغییراتی در خلق و خو ، توانایی های رفتاری و ارتباطی را در بر می گیرد. بیماری های مرتبط با دمانس شامل: دمانس عروقی ، دمانس گیجگاهی-پیشانی یا بیماری پیک ، بیماری کروتزفلد-ژاکوب ، و دمانس لوی بادی می باشند)
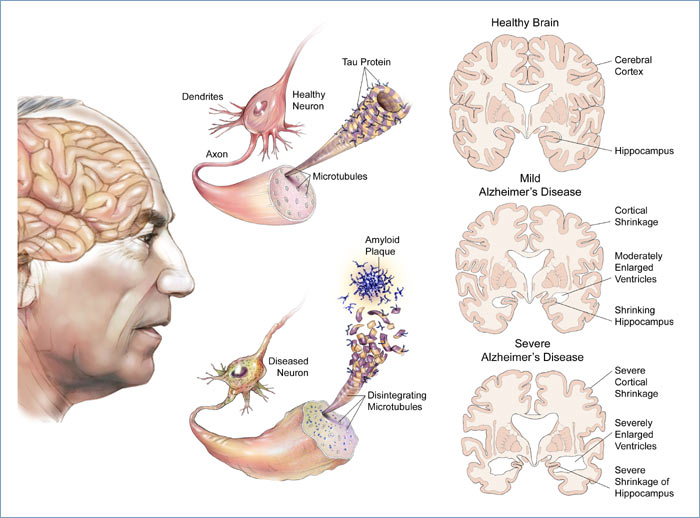
این بیماری در ابتدا توسط دکتر آلویز آلزایمر در 1906 شناسایی گردید. او دو علامت از بیماری را توصیف نمود: پلاک ها(plaques)-رسوبات متراکم ریز فراوان پراکنده شده در سرتاسر مغز که برای سلول های مغزی در سطوح اضافی سمی شده و گرهک ها یا کلافه های مارپیچی شکل(tangles) که در فرایندهای حیاتی دخالت کرده و در نهایت سلول های زنده را پر می کنند. زمانی که سلول های مغز تخریب شده و نابود شوند ، مغز به طور چشمگیری در برخی نواحی کوچک می گردد. این کوچک شدگی مغز در طول زمان ادامه خواهد داشت
با پیشرفت بیماری و تاثیر گذاشتن بر روی نواحی از مغز ، توانایی های مختلف مختل می شوند. نتیجه شامل تغییراتی در توانایی ها و رفتار است. در حال حاضر ، زمانی که یک توانایی از دست رود ، بر نمی گردد. با اینحال ، برخی تحقیقات در حال حاضر نشان می دهند که بعضی از بازآموزی ها ممکن می باشند.
اگرچه دوره بیماری آلزایمر برای هر نفر منحصر می باشد ، اما علایم مشترک بسیاری وجود دارد. اولین علایم قابل مشاهده اغلب به اشتباه تصور می شود که مربوط به سن ، یا نشانه هایی از استرس باشد. در مراحل اولیه ، شایع ترین علامت تشخیص داده شده ، ناتوانی در به خاطر آوردن اطلاعات جدید ، مانند اشکال در به خاطر آوردن رویدادها و وقایع جدید می باشد. زمانی که احتمال بیماری آلزایمر می رود ، تشخیص معمولا توسط ارزیابی های رفتاری و آزمایشات شناختی که اغلب با اسکن مغز در صورت لزوم همراه است تایید می شود.
با پیشرفت بیماری ، علایمی از جمله گیجی ، تحریک پذیری ، و پرخاشگری ، نوسانات خلقی ، اختلال زبانی(مشکل تکلم و بیان) ، از دست دادن حافظه به مدت طولانی ، و انزوای بیمار بروز می کنند. به تدریج عملکردهای جسمی از دست رفته ، در نهایت به مرگ منتهی می شود. ارزیابی پیش شناخت فردی مشکل است ، زیرا مدت بیماری متغیر است. بیماری آلزایمر برای یک دوره ی نامشخص زمانی پیش از آن که کاملا ظاهر شود و سال ها به صورت تشخیص داده نشده پیشروی می کند. میانگین طول عمر پس از تشخیص در حدود هفت سال است. کمتر از سه درصد از مبتلایان چهارده سال پس از زمان تشخیص زنده می مانند.
از آنجایی که بیماری آلزایمر قابل علاج نمی باشد و زوال آفرین بوده ، سرپرستی از بیماران ضروری است. نقش پرستار اصلی اغلب به عهده همسر یا بستگان نزدیک بیمار می باشد. در کشورهای توسعه یافته ، بیماری آلزایمر یکی از پرهزینه ترین بیماری ها برای جامعه می باشد.
تاریخچه بیماری:
فلاسفه و پزشکان یونان و روم باستان افزایش دمانس را با پیری مرتبط می دانستند. تا اینکه در سال 1901 ، روان شناس آلمانی آلوئیز آلزایمر اولین مورد شناخته شده بیماری آلزایمر را در یک زن پنجاه ساله به نام آگوستی دی شناسایی نمود. دکتر آلزایمر پیگیری کرد تا اینکه آن زن در سال 1906 فوت نمود ، او این مورد را اولین بار گزارش نمود. در طول پنج سال بعد ، یازده مورد مشابه در متون پزشکی گزارش گردید ، برخی از آنها هنوز از اصطلاح بیماری آلزایمر استفاده می کنند.
این بیماری در ابتدا به عنوان بیماری مشخص توسط امیل کراپلین بعد از فرونشاندن برخی از مشخصات بالینی(توهمات و هذیان ها) و پاتولوژیکی(تغییرات تصلب شرایین) مندرج در گزارش اصلی آگوستی دی توصیف گردید. او بیماری آلزایمر را به شمار آورد ، همچنین دمانس یا زوال عقل سالخوردگی توسط کراپلین به عنوان زیر شاخه ای از دمانس پیری در ویرایش هشتم از کتاب روان پزشکی منتشر شده ی خود در 1910سال نامیده شد.
این در نهایت به تشخیص بیماری آلزایمر مستقل از سن انجامید. واژه ی دمانس پیری از نوع آلزایمر(SDAT) برای مدتی به منظور توصیف بیماری در افراد بالای 65 سال بکار برده می شد. در نهایت ، واژه ی بیماری آلزایمر به طور رسمی در نامگذاری پزشکی برای توصیف بیماران در تمامی سنین با یک الگوی علامت شایع مشخص ، دوره ی بیماری ، و نوروپاتولوژی انتخاب گردید.
از دست رفتن حافظه که زندگی روزمره را مختل می نماید روند طبیعی پیری نمی باشد. آن ممکن است یکی از علایم بیماری آلزایمر باشد ، بیماری مخرب مغز که زوال عقلی تدریجی را در حافظه ، فکر کردن و مهارت های استدلالی را ایجاد می نماید. هر فردی ممکن است یکی یا بیشتر این علایم را در درجات مختلف تجربه نماید. اگر شما متوجه هر کدام از آنها شدید ، حتما به پزشک مراجعه کنید.
۱۰ علامت هشدار دهنده ی بیماری آلزایمر

1-افت حافظه که بر روی عملکرد روزمره تاثیر می گذارد
فراموش کردن گهگاهی قرارهای ملاقات ، اسامی همکاران یا شماره تلفن یک دوست و بعدا به خاطر آوردن آن ها امری طبیعی است. فرد مبتلا به آلزایمر ممکن است چیزهایی را مکرر فراموش کند و بعدا آنها را به یاد نیاورد ، خصوصا چیزهایی که به تازگی اتفاق افتاده باشند.
یکی از شایعترین علایم آلزایمر ، از دست دادن حافظه ، به ویژه فراموش کردن مطالب تازه به ذهن سپرده شده است. بقیه ، شامل فراموش کردن تاریخ ها و رویدادهای مهم هستند ، تکرار نمودن یک مطلب به صورت مرتب ، تکیه بر وسایل کمکی حافظه (مانند ، یادداشت های یادآور ، یا وسایل الکترونیکی) یا اعضای خانواده برای چیزهایی که آنها عادت داشتند تا خود آنها را مدیریت کنند.
2-اشکال در انجام وظایف و کارهای آشنا
افراد مشغول ممکن است گاهی اوقات حواس پرت بشوند. فرد مبتلا به آلزایمر ممکن است در مورد کارهایی که در تمام زندگی برایشان آشنا بوده اند مانند آماده نمودن غذا با مشکل روبرو شوند.
افراد مبتلا به آلزایمر اغلب در اتمام کارها یا وظایف روزانه با سختی روبرو می شوند. گاهی اوقات ، افراد ممکن است در رانندگی تا یک محل آشنا ، مدیریت و کنترل یک بودجه در محل کار یا به خاطر آوردن قواعد یک بازی مورد علاقه با مشکل روبرو شوند.
3-مشکلات زبانی
هرکسی گاهی اوقات در پیداکردن واژه ی صحیح مشکل دارد ، اما فرد مبتلا به آلزایمر ممکن است کلمات ساده را فراموش کند یا کلمات را تعویض نماید ، در درک جمله سازی دچار مشکل می گردد.
افراد مبتلا به آلزایمر ممکن است در دنبال کردن یک مکالمه با مشکل روبرو شوند. آنها ممکن است در وسط یک گفت و گو توقف کنند و هیچ ایده ای برای ادامه ی آن نداشته باشند یا اینکه ممکن است خودشان تکرار کنند. ممکن است در واژگان با اشکال پیش روند ، در یافتن واژه ی صحیح یا اشتباه صدا زدن اشیاء مشکل داشته باشند.
۴- عدم اشراف در مکان و زمان
فراموش کردن روز هفته یا مقصد خود برای یک لحظه امری عادی است. اما فرد مبتلا به آلزایمر ممکن است در خیابان خود گم شود ، و نداند که چطور به آنجا رفته یا چگونه به خانه رسیده.
افراد مبتلا به بیماری آلزایمر ممکن است حساب تاریخ و روزها ، فصل ها و گذشت زمان را از دست بدهند. آنها ممکن است در درک چیزی که ممکن است اتفاق فوری باشد یا نه با مشکل روبرو شوند. گاهی اوقات آنها ممکن است جایی که هستند یا چطوری به آنجا رفتند را فراموش کنند.
۵-قضاوت ضعیف
افراد ممکن است گاهی اوقات در صورت ابتلا به بیماری رفتن نزد یک پزشک را به تاخیر بیاندازند ، اما بالاخره مراقبت پزشکی را درخواست می کنند. فرد مبتلا به آلزایمر ممکن است دارای قضاوت ضعیفی باشد ، مثلا متوجه یک مشکل پزشکی که نیاز به مراقبت دارد یا پوشیدن لباس زیاد در یک روز داغ نباشد.
افراد مبتلا به آلزایمر ممکن است تغییراتی را در قضاوت یا تصمیم گیری تجربه کنند. برای مثال ، ممکن هنگام سروکار داشتن با پول ، قضاوت ضعیفی داشته باشند. ممکن است توجه کمتری در آراستن یا تمیز نگه داشتن خود صرف نمایند.
6-مشکلات تفکر انتزاعی
گاهی اوقات ، افراد ممکن است در وظایف یا کارهایی که نیازمند تفکر انتزاعی است مانند تراز کردن یک چک بانکی مشکل داشته باشند. فرد مبتلا به آلزایمر ممکن است مشکلات چشمگیری در چنین کارهایی داشته باشد ، برای مثال تشخیص ندهد که ارقام چک بانکی چه معنایی را می دهند.
7-جابجا گذاشتن اشیاء
هر کسی می تواند به طور موقت کیف پول یا دسته کلید را جابجا بگذارد. فرد مبتلا به آلزایمر ممکن است اشیاء را در جاهای نامناسب قرار دهد: اتو در فریزر یا یک ساعت مچی در ظرف شکر
8- تغییرات در خلق و خو و رفتار
هر کسی گاهی اوقات ناراحت یا بدخلق می شود. فرد مبتلا به آلزایمر می تواند نوسانات خلقی متغیری را بروز کند- بدون هیچ دلیل مشخص زیر گریه بزند یا عصبانی شود.
9-تغییرات در شخصیت
شخصیت افراد می تواند تا حدودی با سن تغییر نماید. اما فرد مبتلا به آلزایمر می تواند گیج ، مظنون ، یا منزوی گردد. تغییرات ممکن است شامل بی علاقگی یا بی توجهی ، ترس ، یا کنش نمایی و تخلیه هیجانی کردن باشند.
10-کاهش ابتکار و نوآوری
خسته شدن و بیزار شدن از کار خانه ، فعالیت های شغلی ، یا مسئولیت های اجتماعی امری عادی است ، اما بیشتر افراد دوباره شروع به نوآوری و خلاقیت می کنند. فرد مبتلا به آلزایمر ممکن است بسیار منفعل گردد.
مراحل بیماری:
مرحله ی پیش دمانس:
نخستین علایم اغلب به اشتباه در ارتباط با پیری یا استرس تصور می شوند. آزمایش جامع روان شناختی عصبی می تواند مشکلات خفیف ادراکی را تا هشت سال پیش از آنکه فرد معیارهای بالینی را برای تشخیص بیماری آلزایمر انجام دهد نشان دهد. این علایم اولیه می توانند بیشتر مجموعه فعالیت های روزمره ی زندگی را تحت تاثیر قرار بدهند. از دست دادن حافظه چشمگیرترین نقص بوده ، که به صورت اشکال در به خاطر آوردن مطالب جدید خود را نشان خواهد داد.
مشکلات کوچک و عملکردهای اجرایی از جمله حواس جمعی ، برنامه ریزی ، انعطاف پذیری ، و فکر کردن ، یا اختلالات در حافظه ی معنایی(حافظه ای از معانی و مفاهیم) ، نیز می توانند علامتی از مراحل اولیه بیماری آلزایمر باشند. عدم واکنش و پاسخ را می توان در این مرحله مشاهده نمود و مرحله ی پیش بالینی بیماری اختلال شناختی خفیف نامیده شده است.
مرحله ی اولیه:
در افراد مبتلا به بیماری آلزایمر ، افزایش در اختلال یادگیری و حافظه در نهایت منجر به تشخیص قطعی می شود. در بخش کوچکی از آنها ، مشکلات زبانی ، عملکردهای اجرایی ، نا ادراکی یا فقدان حس ، اختلال در حرکات عضلانی و ناتوانی در انجام کارهای جسمی-کنش پریشی ، مشکلات چشمگیرتری از مشکلات مربوط به حافظه می باشند. بیماری آلزایمر بر روی تمامی ظرفیت های حافظه به طور یکسان تاثیر نمی گذارد. خاطرات قدیمی تر از زندگی شخص(حافظه ی اپیزودیک) ، حقایق آموخته(حافظه ی سمانتیک یا معنایی) ، و حافظه ی ضمنی(حافظه ای از بدن در مورد چگونگی انجام کارها ، مانند استفاده از یک چنگال برای غذاخوردن) تا حد کمتری نسبت به واقعیت ها یا خاطرات جدید تحت تاثیر قرار می گیرند.
مشکلات زبانی عمدتا با کاهش در پیداکردن واژگان و روانی در گفتار مشخص می شود ، که به ناتوان شدن زبان گفتاری و نوشتاری منجر خواهد شد. در این مرحله ، شخص مبتلا به آلزایمر معمولا قادر به برقرار کردن عقاید ساده می باشد. در حالیکه انجام وظایف دقیق حرکتی و عضلانی مانند نوشتن ، نقاشی کردن یا لباس پوشیدن ، حرکت خاص ، هماهنگی و برنامه ریزی مسائل(اختلال در حرکات عضلات) ممکن است وجود داشته باشد. با پیشرفت بیماری ، افراد مبتلا به بیماری آلزایمر اغلب می توانند بسیاری از وظایف را به طور مستقل انجام دهند ، اما ممکن است نیاز به کمک یا نظارت بر فعالیت های شناختی خود داشته باشند.

مرحله ی میانی:
زوال عقلی پیش رونده در نهایت استقلال فرد را با اشکال روبرو می کند. مشکلات گفتاری به دلیل ناتوانی در به یاد آوردن واژگان بروز می کند ، که به تعویض مکرر واژگان ناصحیح می انجامد. مهارت های خواندن و نوشتن نیز به تدریج فراموش می شوند. سکانس های حرکتی پیچیده با گذشت زمان و پیشرفت بیماری کمتر هماهنگ می شده ، بنابراین خطر افتادن افزایش می یابد. در طول این مرحله ، مشکلات مربوط به حافظه بدتر شده و فرد ممکن است بستگان نزدیک خویش را نشناسد. حافظه ی بلند مدت ، که پیش از این سالم بوده ، دچار اختلال می شود.
تغییرات رفتاری و روان شناختی عصبی شایع تر می شوند. علایم رایج شامل سردرگمی ، تحریک پذیری ، تندخویی و تاثیر بی ثباتی بوده که به گریه ، طغیان و پرخاشگری بی اختیاری ، یا مقاومت در برابر مراقبت می انجامد. قریب به 30 درصد از بیماران گرفتار عدم هویت کژپنداری و دیگر علایم توهمی می شوند. بیماران
همچنین روان آگاهی از روند و محدودیت های بیماری شان را از دست می دهند(anosognosia). بی اختیاری ادراری می تواند بروز نماید. این علایم برای بستگان و مراقبت کنندگان بیمار ایجاد تنش می کند ، که با انتقال بیمار از مراقبت در منزل به دیگر مراکز ویژه مراقبت طولانی می توان آن را کاهش داد.
مرحله ی پیشرفته:
در طول مرحله ی پایانی بیماری آلزایمر ، بیمار کاملا وابسته و متکی به افراد مراقبت کننده می شود. زبان به عبارات و جملات ساده یا حتی تک واژه ها کاهش یافته ، در نهایت به از دست دادن کامل کلام و گفتار می انجامد. با وجود از یاد بردن توانایی های گفتاری ، بیماران اغلب می توانند سیگنال های احساسی را درک کنند. اگرچه پرخاشگری ممکن است هنوز وجود داشته باشد ، اما بی حسی و خستگی شدید پیامدهای خیلی شایعتر می باشند. بیماران در نهایت قادر به انجام حتی ساده ترین کارها بدون کمک نخواهند بود.
متخصصان مراحلی را برای توصیف چگونگی تغییر توانایی های فرد از عملکرد نرمال طی بیماری آلزایمر پیشرفته طراحی نموده اند:
مرحله ی اول: بدون آسیب و اختلال
مرحله ی دوم: زوال خیلی خفیف
مرحله ی سوم: زوال خفیف
مرحله ی چهارم: زوال متوسط
مرحله ی پنجم: زوال نسبتا شدید
مرحله ی ششم: زوال شدید
مرحله ی هفتم: زوال خیلی شدید
مهم است به یاد داشته باشیم که مراحل ، راهنماهای کلی هستند ، و علایم بسیار تغییر می کنند. بیماران علایم یکسان یا پیشروی یکسان در بیماری را تجربه نخواهند کرد.
این ساختار هفت مرحله ای بر اساس سیستم طراحی شده توسط بری ریسبرگ متخصص بالینی می باشد.

مرحله ی اول:
بدون آسیب و اختلال(عملکرد نرمال)
فرد هیچ گونه مشکلات مربوط به حافظه را تجربه نخواهد کرد. مصاحبه پزشک متخصص با فرد بیمار هیچ گونه شواهدی از علایم را نشان نمی دهد.
مرحله ی دوم:
زوال شناختی خیلی خفیف(ممکن است تغییرات عادی مربوط به سن یا علایم اولیه ی بیماری آلزایمر باشد)
فرد ممکن است احساس نماید که در حال از یاد بردن و خطای حافظه می باشد-فراموش کردن واژگان آشنا یا محل اشیاء هر روزه ، اما هیچ علایمی نمی تواند در حین یک معاینه ی پزشکی یا توسط دوستان ، خانواده یا همکاران شناسایی شود.
مرحله ی سوم:
اختلال شناختی خفیف(بیماری آلزایمر مرحله ی اولیه را می توان در بعضی مبتلایان نه همه که دارای این علایم هستند تشخیص داد)
دوستان ، خانواده یا همکاران متوجه مشکلاتی می شوند. در طول یک معاینه ی مفصل پزشکی ، پزشکان ممکن است قادر به شناسایی مشکلاتی در حافظه یا تمرکز فرد بشوند. مشکلات رایج مرحله ی سوم شامل موارد زیر می باشد:
-مشکلات شایان توجه مربوط به واژه یا نام صحیح
-مشکل به یاد آوردن اسامی هنگام روبرویی و ملاقات با افراد جدید
-داشتن مشکل شایان توجه تر در انجام کارهای اجتماعی و فراموش کردن اطلاعاتی که تازه آنها را مطالعه کرده
-گم کردن یا جابجاگذاشتن یک شی ء ارزمشند.
-افزایش مشکل در برنامه ریزی یا سازمان دهی.
مرحله ی چهارم:
اختلال شناختی متوسط(بیماری آلزایمر مرحله ی خفیف تا اولیه)
در این مرحله ، یک مصاحبه ی پزشکی دقیق بایستی قادر به شناسایی نمودن مشکلات روشن و صریح در چندین زمینه باشد:
-فراموشی وقایع جدید
-ناتوانی در محاسبه ریاضی ذهنی برای مثال ، شمارش به معکوس از 100 تا 7
-مشکل بیشتر در انجام وظایف پیچیده ، مانند ترتیب دادن شام برای مهمانان ، پرداخت چک یا مدیریت امور مالی
-فراموشی درباره ی تاریخچه ی شخصی خود
-بدخلق و منزوی شدن ، خصوصا در وضعیت های رقابتی ذهنی یا اجتماعی
مرحله ی پنجم:
زوال شناختی نسبتا شدید(بیماری آلزایمر متوسط یا مرحله ی میانی)
فاصله و شکاف در حافظه و فکر کردن برجسته می باشد ، و افراد نیاز به کمک در فعالیت های روزانه دارند. در این مرحله ، مبتلایان ممکن است:
-قادر به یاد آوردن آدرس یا شماره تلفن خود یا دبیرستان یا دانشگاهی که از آنجا فارغ التحصیل شده اند نباشند.
-گیج شدن درباره ی جایی که آنها هستند یا تاریخ روز
-مشکل داشتن در حساب ذهنی مانند شمارش معکوس
-نیاز به کمک در انتخاب لباس صحیح مناسب فصل یا موقعیت
-به یاد آوردن جزئیات چشمگیر درباره ی خود و خانواده
-نیاز به کمک نداشتن در خوردن یا استفاده از توالت
-حافظه در حال بدترشدن می باشد ، تغییرات شخصیتی ممکن است بروز کرده و افراد نیاز به کمک گسترده ای در فعالیت های روزانه داشته باشند.
مرحله ی ششم:
(بیماری آلزایمر نسبتا شدید یا مرحله ی میانی)
در این مرحله ، افراد ممکن است:
-آگاهی از تجربیات جدید همچنین آگاهی از اطراف خود را از دست بدهند
-نام خود را به یاد آورند اما در مورد تاریخچه ی شخصی شان مشکل داشته باشند
-چهره های آشنا و غیر آشنا را تشخیص بدهند اما در به خاطر آوردن اسم همسر یا فرد مراقبت کننده مشکل داشته باشند
-در لباس پوشیدن صحیح به کمک نیاز داشته باشند ، و ممکن است بدون نظارت ، اشتباهاتی مانند پوشیدن پیژامه به جای لباس های روز یا پوشیدن کفش را انجام بدهند
-تغییرات بزرگی را در الگوهای خواب تجربه کنند-خوابیدن در طول روز و شب هنگام پر تلاطم و بی قرار شوند
-در کنترل جزئیات توالت رفتن نیاز به کمک داشتن
-در کنترل مثانه یا شکم خود مشکل مکرر فزاینده داشته باشند.
-تغییرات رفتاری و شخصیتی بزرگی از جمله سوء ظن و توهمات یا رفتار وسواسی و تکراری مانند شستن دست
- گم شدن
مرحله ی هفتم:
زوال شناختی خیلی شدید (بیماری آلزایمر شدید یا مرحله ی پایانی)
در مرحله ی پایانی آلزایمر ، بیماران توانایی پاسخ دادن ، انجام مکالمه و در نهایت کنترل حرکت را از دست می دهند. آنها ممکن است هنوز واژگان یا عباراتی را بیان کنند.
در این مرحله ، بیماران بیش از مراقبت شخصی روزانه شان نیاز به کمک ، از جمله غذا خوردن یا استفاده از توالت دارند. همچنین ممکن است توانایی خندیدن ، نشستن بدون کمک و بالا نگهداشتن سر خود را از دست بدهند.
سرعت عمل یا واکنش غیر طبیعی می شود. عضلات سفت می شوند. در بلعیدن و قورت دادن مشکل پیدا می کنند.
علل بیماری:
چندین فرضیه در حال رقابت وجود دارند که در حال تلاش برای بیان علت بیماری می باشند. قدیمی ترین فرضیه ، که در آن در دسترس ترین روشهای دارو درمانی مبنا هستند ، فرضیه ی کولینرژیک است ، که پیشنهاد می کند بیماری آلزایمر به علت کاهش سنتز استیل کولین انتقال دهنده یا پیام رسان عصبی ایجاد می شود. بر روی اندامها یا سلولهای هدف گیرندههایی وجود دارد که موجب تاثیر نوروترانسمیترهای آزادشده بر اثر تحریک سامانه اتونوم بر آنها میشود . تنوع این گیرندهها موجب اختصاصی شدن تاثیر میانجیهای عصبی بر بافتهای مختلف میشود. گیرنده استیلکولین پروتئین غشائی درونی است که نسبت به اتصال ترارسان عصبی استیلکولین واکنش نشان میدهد. فرضیه ی کولینرژیک پشتیبانی گسترده ای را به خود اختصاص نداده است ، عمدتا به این خاطر که داروهایی به منظور درمان کمبود استیل کولین خیلی موثر نبوده اند. دیگر تاثیرات کولینرژیک نیز گردیده است ، برای مثال ، شروع تجمع آمیلوئید در مقدار زیاد ، به التهاب عصبی منجر می شود.
در سال 1991 ، فرضیه ی آمیلوئید نتیجه گیری نمود که رسوبات آمیلوئید بتا(Aβ) علت اساسی بیماری می باشد. پشتیبانی از این نتیجه گیری از محل این ژن برای پروتئین پیش ساز آمیلوئید بتا(APP) بر روی کروموزوم شماره ی 21 نشات می گیرد ، همراه با این واقعیت که افراد مبتلا به تریزومی 21 (سندروم داون) یک نسخه ی ژن اضافی دارند که تقریبا به صورت گسترده بیماری آلزایمر را تا سن 40 سالگی بروز می کند. همچنین APOE4 ، عامل اصلی خطر ژنتیکی برای بیماری آلزایمر می باشد ، که به تولید بیش از حد آمیلوئید در مغز پیش از نمایان شدن علایم بیماری آلزایمر می انجامد. شواهد بیشتر نشان می دهند که موش های تراریخته که یک جهش از ژن APP انسان را بیان می کند دچار پلاک های آمیلوئیدی فیبریلار و پاتولوژی مغز با نقائص و اختلالات یادگیری زمانی و مکانی می شوند.
محققان به الیگومرهای Aβ(تجمعاتی از مونومرهای بسیار) غیر پلاکی به عنوان شکل بیماری زایی اولیه ی Aβ گمان برده اند. این الیگومرهای سمی ، که به عنوان لیگاندهای پخش پذیر مشتق شده از آمیلوئید (ADDLs) نیز اشاره می شوند ، با رسپتور یا گیرنده ی سطح بر روی نورون ها پیوند داده و ساختار سیناپس را عوض می کنند ، در نتیجه ارتباطات نورونی را مختل می نمایند. سیناپس نقطه اتصال دو سلول عصبي در يك مسير مربوط به سلسله اعصاب است كه انتهاي آكسون يك سلول عصبي تقريبا به نزديكي دندريت سلول عصبي ديگر مي رسد. در اين نقطه كه دو سلول عصبي با هم ارتباط پيدا مي كنند تكانه سلول عصبي اول تكانه اي در سلول عصبي دوم ايجاد مي كند.
در سال 2009 این تئوری روزآمد شد ، حاکی از آن است که یکی از هم خانواده های نزدیک پروتئین آمیلوئید بتا ، و نه لزوما خود آمیلوئید بتا ، ممکن است عامل اصلی در این بیماری باشد. این نظریه بر آن است که مکانیزم مرتبط با آمیلوئید که اتصالات نورونی در مغز را کاهش می دهد ممکن است توسط فرآیندهای مرتبط با پیری ، زندگی آینده را مورد هدف قرار دهد تا باعث تباه شدن عصبی بیماری آلزایمر شود. N-APP ، یک بخش از APP از پپتیدN-terminus است ، مجاور با آمیلوئید بتا و از APP توسط یک از آنزیم های مشابه از جدا می شود. N-APP مسیر خود تخریبی را با اتصال به یک گیرنده عصبی بنام گیرنده مرگ 6 مورد هدف قرار می دهد(DR6 همچنین موسومTNFRSF21) . DR6 در نواحی از مغز انسان به شدت بیان شده که بیشتر تحت تاثیر آلزایمر می باشد. در این مدل ، آمیلوئید بتا نقش یک مکمل را با کاهش عملکرد سیناپسی ایفا می کند.
مطالعه ای در سال 2004 نشان داد که رسوب پلاک های آمیلوئید به خوبی هماهنگ با از دست دادن نورون نمی باشد. این مشاهده فرضیه ی تاو را پشتیبانی می کند ، در این ایده اختلالات پروتئین تاو بیماری را شروع می نماید. در این مدل ، تاو هیپر فسفریله شده شروع به جفت شدن با دیگر رشته های تاو می نماید. سرانجام ، آنها کلافه های مارپیچی شکل نوروفیبریلار را در داخل اجسام سلول عصبی تشکیل می دهند. وقتی که این اتفاق می افتد ، میکروتوبول ها از هم گسیخته می شوند ، و سیستم انتقال نورون را در هم پاشیده و از بین می برند. این امر ممکن است به اولین اختلالات در ارتباط بیوشیمیایی بین نورون ها منجر شده و بعد از آن به مرگ سلول بیانجامد.
فرضیه ی دیگری اظهار می کند که این بیماری ممکن است با خرابی و آسیب میلین مربوط به سن در مغز ایجاد شود. دمیلینه شدن به اختلالات انتقال اکسونی و از دست رفتن نورون ها منجر می شود. آهن آزاد شده در طول خرابی میلین فرض می شود که آسیب بیشتری را ایجاد نماید. فرایندهای تعمیر میلین هموستاتیک در پیشرفت رسوبات پروتئینی از قبیل آمیلوئید بتا و تاو دخیل می باشد.
مبتلایان به آلزایمر کاهش 70 درصدی از سلول های لوکوس سرولئوس را نشان می دهند که نوراپی نفرین (علاوه بر نقش انتقال دهنده و پیام رسان عصبی) را فراهم می کنند که به صورت محلی از واریکوزیته هایی به عنوان عامل ضد التهابی اندوژنی در محیط میکرو در اطراف نورون ها ، سلول های گلیال ، و رگ های خونی در نو قشر مغز و هیپوکامپ نفوذ می کند. سلول های لوکولس سرولئوس مجموعه ای متمرکز از سلول های عصبی درون پل مغزی هستند که آکسون آنها پیام رسان عصبی نوراپی نفرین را ترشح می کند. نشان داده شده است که نوراپی نفرین میکروگلیای موش را تحریک کرده تا تولید القا شده ی Aβ از سایتوکین ها و فاگوسیتوسیزهایشان از Aβ را فرونشاند. این نشان می دهد که تخریب لوکوس سرولئوس ممکن است مسئول افزایش رسوب Aβ در مغز مبتلایان به آلزایمر باشد.
آسیب شناسی نورونی:
بیماری آلزایمر با از دست رفتن نورون ها و سیناپس ها در قشر مخ و برخی از نواحی زیر قشر مخ مشخص می شود. این کاهش به تحلیل یا آتروفی چشمگیر نواحی آسیب دیده ، از جمله تخریب و زوال در لوب گیجگاهی و لوب آهیانه ، و بخش هایی از قشر قدامی مغز و شکنج سینگولا(گیروس سینگولات) مغز منجر می شود. مطالعات با استفاده از MRI و PET کاهش در اندازه ی نواحی ویژه ی مغز بیماران را نشان داده اند.
هم پلاک های آمیلوئیدی و هم کلافه ها یا گرهک های مارپیچی شکل نوروفیبریلاری به وضوح توسط میکروسکوپ در مغز مبتلایان به آلزایمر قابل مشاهده می باشند. پلاک هایی که متراکم هستند ، عمدتا از رسوبات غیر قابل انحلال پپتید آمیلوئید بتا و جسم سلولی خارج و اطراف نورون ها می باشند. کلافه ها یا گرهک ها ، تجمعاتی از پروتئین وابسته به میکروتوبول تاو هستند که هیپر فسفریله شده و داخل سلول های خودشان تجمع می کنند. اگرچه بسیاری از افراد مسن تر دچار بعضی از پلاک ها و کلافه هایی به عنوان پیامد پیری می شوند ، اما مغز بیماران مبتلا به بیماری آلزایمر تعداد بیشتری از آنها را در نواحی خاص مغز مانند لوب گیجگاهی نشان می دهد.
بیوشیمی بیماری:
بیماری آلزایمر بوسیله ی تجمع غیر طبیعی پروتئین های تاخورده ی آ-بتا و تاو در مغز ایجاد می شود. پلاک ها از پپتیدهای کوچک ، آمینواسیدهایی به طول 39-43 ، بنام آمیلوئید بتا (همچنین به صورت A-beta یا Aβنوشته می شود) درست می شوند. آمیلوئید بتا بخشی از یک پروتئین بزرگتر بنام پروتئین پیش ساز آمیلوئید(APP) ، پروتئین تراشامه ای که از طریق غشای نورونی نفوذ می کند. APP برای رشد نورون ، زنده ماندن و ترمیم بعد از جراحت ضروری است. در بیماری آلزایمر ، روندی ناشناخته باعث می شود تا APP به بخش های کوچکتری توسط آنزیم ها از طریق پروتئولیز یا تجزیه ی مواد پروتئینی تقسیم گردد. یکی از این بخش ها رشته هایی از آمیلوئید بتا را به وجود آورده ، توده هایی را تشکیل داده که در خارج نورون ها در تشکیلاتی متراکم موسوم به پلاک های پیری ، رسوب کنند.
بیماری آلزایمر بواسطه ی تجمع غیر طبیعی پروتئین تاو ، نیز در نظر گرفته می شود. هر نورورن یک اسکلت سلولی دارد ، یک ساختار پشتیبانی داخلی که تا حدودی از سازه هایی بنام میکروتابول ها ساخته می شود. این میکروتابول ها مانند مسیرها و راههایی عمل کرده ، مواد غذایی و مولکول ها را از جسم سلولی به انتهای اکسون انتقال می دهند. پروتئین تاو ، میکروتابول های فسفریله شده را تقویت می کند و بنابراین پروتئین وابسته به میکروتابول نامیده می شود. در بیماری آلزایمر ، تاو دستخوش تغییرات شیمیایی شده ، و هیپر فسفریله می شود ، سپس شروع به جفت شدن با دیگر رشته ها کرده و کلافه های نوروفیبریلاری و سپس از هم گسیختگی سیستم انتقال نورون را ایجاد می کند.
مکانیسم بیماری:
اینکه چگونه اختلالات و تجمع پپتید آمیلوئید بتا موجب پاتولوژی بیماری آلزایمر می شود ، دقیقا معلوم نمی باشد. فرضیه ی آمیلوئید به صورت سنتی اشاره به تجمع پپتیدهای آمیلوئید بتا به عنوان پیامد اصلی تخریب نورون دارد. انباشتگی فیبرها و رشته های آمیلوئیدی تجمع یافته ، که تصور می شود شکل تاکسیک پروتئین مسئول مختل سازی هموستاسیز یون کلسیم سلول باشد ، مرگ سلول برنامه ریزی شده را ایجاد می نماید(آپوپتوسیز). همچنین معلوم شده است که Aβ به طور انتخابی در میتوکندری سلول های مغزهای مبتلا شده به آلزایمر تشکیل می شود و نیز مانع از عملکرد آنزیم های خاص و بکارگیری گلوکز توسط نورون ها می شود.
فرایندهای التهابی مختلف و سایتوکین ها نیز ممکن است در آسیب شناسی بیماری آلزایمر نقشی داشته باشند. التهاب یک نشانگر کلی از آسیب بافت در هر بیماری است ، و می تواند در آسیب بافت بیماری آلزایمر یا ثانویه باشد یا نشانه ای از پاسخ ایمونولوژیکی باشد.
عوامل خطرساز ابتلا به بیماری:
محققان فاکتورها و عواملی را شناسایی نموده اند که خطر ابتلا به آلزایمر را افزایش می دهند. مهمترین عوامل خطر ابتلا از جمله سن ، سابقه ی بیماری خانوادگی و وراثت نمی توانند تغییر کنند ، اما شواهد حاکی از آن است که عوامل دیگری ممکن است تاثیرگذار باشند.
سن:
بزرگترین فاکتور خطر ابتلا به بیماری آلزایمر بالارفتن سن می باشد. اکثر مبتلایان ، 65 سال به بالا می باشند. احتمال مبتلا شدن به بیماری آلزایمر در حدود هر 5 سال بعد از سن 65 سالگی دو برابر می شود. بعد از سن 65 سالگی ، خطر ابتلا به نزدیک 50 درصد می رسد. یکی از بزرگترین اسرار و رموز بیماری آلزایمر این است که چرا خطر ابتلا با افزایش سن و پیرتر شدن به طور چشمگیری افزایش می یابد.
سابقه ی بیماری خانوادگی:
یکی دیگر از فاکتورهای خطر ابتلا ، پیشینه ی خانوادگی است. آنهایی که بستگان درجه اول مانند والدین ، برادر ، خواهر یا فرزند مبتلا به آلزایمر دارند به احتمال بیشتری دچار این بیماری می شوند. اگر بیش از یک عضو خانواده دارای این بیماری باشد خطر ابتلا افزایش می یابد. زمانی که بیماری ها تمایل بازگشت در خانواده ها را داشته باشند ، فاکتورهای وراثت(ژنتیک) یا فاکتورهای محیطی ، یا هر دو ممکن است نقشی داشته باشند.
آلومینیوم علت بیماری نمی باشد:
در طول دهه های 1960 و 1970 ، آلومینیوم به عنوان مظنون در ایجاد بیماری آلزایمر نمایان شد. این ظن به نگرانی هایی در مورد قرارگیری همه روزه با عنصر آلومینیوم از طریق منابعی مانند ظروف آشپزی ، فویل ، قوطی های آشامیدنی ، ضد اسیدها انجامید. از آن زمان ، مطالعات موفق به تایید هر گونه نقش آلومینیوم در ایجاد آلزایمر نشده اند. تقریبا تمامی محققین امروزه بر روی دیگر زمینه های تحقیقاتی توجه و تمرکز دارند ، و متخصصان معدودی عقیده دارند که منابع هر روزه از آلومینیوم ایجاد خطر می کند.
ژنتیک(وراثت):
محققین می دانند که ژن ها در بیماری آلزایمر دست دارند. دو نوع از ژن ها هستند که می توانند در تحت تاثیر قرار دادن بر روی فردی که دچار بیماری است نقشی داشته باشند-ژن های خطر ساز(risk genes) و ژن های تعیین کننده(deterministic genes). ژن های آلزایمر در هر دو دسته یافت شده اند.
آزمایش ژنتیک:
آزمایشات ژنتیک برای ژن APOE-e4 و ژن های کمیابی که به طور مستقیم باعث بیماری آلزایمر می شوند در دسترس هستند. با اینحال ، متخصصان سلامت در حال حاضر آزمایش ژنتیک روتین را برای بیماری آلزایمر پیشنهاد نمی کنند. آزمایش برای APOE-e4 گاهی اوقات به عنوان بخشی از مطالعات تحقیقاتی در بر گرفته می شود.
ژن های خطرساز ، احتمال دچار شدن به بیماری را افزایش می دهند ، اما بروز آن را تضمین نمی کنند. محققین تاکنون چندین ژن ابتلا درگیر در بیماری آلزایمر را شناسایی نموده اند. ژن ابتلا با شدیدترین تاثیر به نام ژن آپولیپوپروتئین (APOE-e4) می باشد. محققین برآورد می کنند که ژن APOE-e4 ممکن است عامل 20 تا 25 درصد از موارد آلزایمر باشد.
ژن APOE-e4 یکی از سه شکل رایج ژن APOE بوده ، دیگر ژن ها شامل APOE-e2 و APOE-e3 هستند. همه یک نسخه از چند شکل ژن APOE را از هر یک از والدین به ارث می برند. افرادی که ژن APOE-e4 را از یکی از والدین خود به ارث برند افزایش خطر ابتلا به آلزایمر را دارا می باشند. افرادی که ژن APOE-e4 را از هر دو والد خود به ارث برند خطر ابتلای بالاتر یکسان اما نه قطعی را دارا می باشند. محققین هنوز مطمئن نیستند که ژن APOE-e4 چگونه خطر ابتلا را افزایش می دهد. علاوه بر افزایش خطر ابتلا ، ژن APOE-e4 ، ممکن است تمایل به بروز کردن علایم بیماری آلزایمر را در سنین پایینتری از حد معمول داشته باشد.
ژن های تعیین کننده به طور مستقیم بیماری را ایجاد می کنند ، ضمانت می کنند هر کسی که آنها را به ارث برد مبتلا به اختلال خواهد شد. محققین تغییراتی را دریافته اند که به طور مستقیم بیماری آلزایمر را در ژن های رمزگذارنده سه پروتئین ایجاد می کنند: پروتئین پیش ساز آمیلوئید(APP) ، پرسنیلین-1 (PS-1) و پرسنیلین-2 (PS-2).
زمانی که بیماری آلزایمر توسط این تغییرات تعیین کننده ایجاد شود ، بیماری آلزایمر اتوزومی غالب(ADAD) یا بیماری آلزایمر خانوادگی نامیده می شود و اعضای خانواده ی بسیاری در چندین نسل به آن مبتلا می گردند. علایم تقریبا همیشه پیش از سن 60 سالگی پیشروی می کنند ، و ممکن است در اوایل دهه های 30 یا 40 سالگی بروز نمایند. تغییرات آلزایمر تعیین کننده تنها در چند صد خانواده در سراسر دنیا یافت شده است. بیماری آلزایمر خانوادگی کمتر از 5 درصد از موارد به حساب می آید.
23 جفت کروموزوم انسانی شامل تمامی 30000 ژنی است که طرح بیولوژیکی انسان بودن را کدگذاری می کنند. این توضیح برهم کنشی کروموزوم های شامل شده در هر یک از سه ژنی که بیماری آلزایمر خانوادگی را ایجاد می کنند و ژن با بیشترین تاثیر بر روی خطر ابتلای آلزایمر را مورد تاکید قرار می دهد.
فاکتورهایی که ممکن است تاثیرگذار باشند:
بیشتر متخصصان عقیده دارند که بخش عظیمی از بیماری آلزایمر در نتیجه ی برهم کنش های پیچیده در بین ژن ها و فاکتورهای ابتلای دیگر روی می دهد. سن ، پیشینه و سابقه خانوادگی و وراثت همگی عوامل خطر ابتلایی هستند که قادر به تغییرآنها نیستیم. در حال حاضر ، تحقیقاتی به منظور آشکار نمودن نشانه ها و سرنخ هایی درباره ی دیگر فاکتورهای خطر ابتلایی که ممکن است قادر باشیم تا از طریق سبک زندگی و انتخاب های تندرستی و مدیریت موثر دیگر شرایط سلامتی تحت تاثیر قرار دهیم.
تروما و ضربه مغزی:
ممکن است یک ارتباط قوی بین آسیب جدی سر و خطر ابتلا در آینده به بیماری آلزایمر وجود داشته باشد ، علی الخصوص زمانی که تروما به صورت پی در پی اتفاق بیافتد یا شامل هوشیاری باشد. با بستن کمربند ایمنی ، پوشیدن کلاه ایمنی هنگام شرکت در مسابقات ورزشی و ایمن و مقاوم سازی خانه ی خود از سر خود محافظت کنید.
ارتباط سر-قلب:
شواهد در حال رشد ، سلامتی مغز را به سلامتی سر ارتباط می دهند. مغز توسط یکی از ارزشمندترین شبکه های رگ های خونی تغذیه می شود. هر ضربان قلب در حدود 20 تا 25 درصد از خون را به سر پمپاژ می کند ، که در آنجا سلول های مغز از حداقل 20 درصد غذا و اکسیژن شریان های خون استفاده می کنند.
خطر ابتلا بیماری آلزایمر یا دمانس عروقی به نظر می رسد که توسط بیماری های بسیاری که به قلب یا رگ های خونی آسیب وارد می کنند افزایش یابد. این ها شامل فشار خون بالا ، بیماری قلبی ، سکته ی مغزی ، دیابت و کلسترول بالا می باشند. برای معاینه کردن سلامتی قلبتان و درمان هرگونه مشکلی که به وجود می آید به پزشک مراجعه کنید.
مطالعات بافت مغزی اهدا شده ، شواهدی اضافه را برای ارتباط قلب-سر فراهم می کنند. این مطالعات پیشنهاد می کنند که پلاک ها و کلافه ها یا گرهک ها به احتمال بیشتری باعث ایجاد علایم آلزایمر چنانچه سکته ی مغزی یا آسیب به رگ های خونی مغز نیز وجود داشته باشند می شوند.
از آنجایی که مردم آمریکای لاتین و آمریکایی های آفریقایی تبار در ایالات متحده میزان بالاتری از بیماری های عروقی را دارا می باشند ، همچنین ممکن است خطر ابتلای بیشتری برای مبتلا شدن به آلزایمر وجود داشته باشد. بر طبق یک مجموعه از شواهد ، عوامل خطر ابتلا برای بیماری های عروقی از جمله دیابت ، فشار خون بالا و کلسترول بالا ممکن است فاکتورهای ابتلا برای آلزایمر و دمانس مربوط به سکته ی مغزی نیز باشند.
ژنتیک:
اکثریت قریب به اتفاق موارد بیماری تک گیر یا اسپورادیک هستند ، به این معنا که که آنها معمولا از نظر ژنتیکی وراثتی نیستند هرچند برخی از ژن ها ممکن است به عنوان عوامل خطر ابتلا عمل کنند. از سوی دیگر ، در حدود یک دهم درصد از موارد اشکال خانوادگی از توارث اتوزومی غالب هستند که معمولا شروعی پیش از سن 65 سالگی دارند.
بیشتر بیماری آلزایمر خانوادگی اتوزومی غالب را می توان به جهش هایی در یکی از سه ژن نسبت داد: پروتئین پیش ساز آمیلوئید(APP) و پرسنیلین-1 و پرسنیلین-2 . بیشترین جهش ها در ژن های APP و پرسنیلین تولید یک پروتئین کوچک به نام 42Aβ را افزایش می دهند ، که جزء اصلی پلاک های پیری است. بعضی از جهش ها تنها نسبت اندازه بین 42 Aβرا تغییر داده و دیگر اشکال اصلی از قبیل Aβ40 بدون افزایش سطوح 42Aβ باقی می مانند. این نشان می دهد که جهش های پرسنیلین می تواند بیماری را ایجاد کند حتی اگر مقدار کلی Aβ تولید شده را پایین آورند و ممکن است به نقش های دیگر پرسنیلین یا نقشی برای تغییرات در عملکرد APP و یا بخش های آن به غیر از Aβ اشاره داشته باشد.
اغلب موارد بیماری آلزایمر که توارث اتوزومی غالب را نشان نمی دهند ، بیماری آلزایمر اسپورادیک یا تک گیر نامیده می شود. با این وجود تفاوت های ژنتیکی ممکن است به عنوان عوامل خطر ابتلا عمل نمایند. بهترین فاکتور خطر ژنتیکی شناخته شده توارث آلل ε4 آپولیپوپروتئینAPOE4 است. بین 40 و 80 درصد از بیماران مبتلا به بیماری آلزایمر دارای حداقل یک آلل apoE4 می باشند. آلل APOE4 خطر ابتلا به این بیماری را تا سه برابر در هتروزیگوت ها و تا پانزده برابر در هموزیگوت ها افزایش می دهند. متخصصان ژنتیک قبول دارند که ژنهای بیشمار دیگری نیز به عنوان عوامل خطر ساز عمل می کنند یا اثرات محافظتی دارند که بر روی پیشرفت بیماری آلزایمر با تظاهر دیرهنگام تاثیر می گذارد. بالغ بر 400 ژن به منظور ارتباط با بیماری آلزایمر اسپورادیک با تظاهر دیرهنگام مورد آزمایش قرار گرفته اند ، که بیشتر با نتایج بیهوده همراه بوده است.
تشخیص:
بیماری آلزایمر معمولا به لحاظ بالینی از پیشینه ی بیمار ، پیشینه ی بستگان بیمار ، و مشاهدات بالینی ، بر اساس حضور ویژگی های نورولوژیکی و روان شناسی عصبی مشخص و عدم وجود شرایط دیگر تشخیص داده می شود. تصویربرداری پیشرفته ی پزشکی به همراه توموگرافی کامپیوتری یا سی تی اسکن(سی تی) و یا تصویربرداری رزونانس مغناطیسی(ام آر آی) و با توموگرافی کامپیوتری گسیل تک فوتون(SPECT) یا توموگرافی گسیل پوزیترون(اسکن پت) می توانند برای کمک به رد کردن دیگر آسیب شناسی مغزی یا زیر گونه های دمانس استفاده شوند. به علاوه ، می توانند تبدیل از مراحل پرودرومی(اختلال شناختی خفیف) به بیماری آلزایمر را پیش بینی نمایند.
ارزیابی عملکرد ذهنی از جمله تست حافظه می تواند وضعیت بیماری را بیشتر مشخص نماید. نهادهای پزشکی معیارهای تشخیصی را برای سهولت و استانداردسازی روند تشخیص برای آموزش به پزشکان ایجاد نموده اند. تشخیص را با دقت بسیار بالایی پس از مرگ زمانی که اطلاعات موجود است و می توان از لحاظ بافت شناسی مورد بررسی قرار داد می تواند تایید شود.
معیارها و ضوابط:
انستیتو ملی اختلالات و سکته های مغزی نورولوژیکی و ارتباطی(NINCDS) و بیماری آلزایمر و انجمن اختلالات مرتبط(ADRDA) (در حال حاضر به عنوان انجمن آلزایمر شناخته می شود) رایج ترین معیارها و ضوابط استفاده شده آلزایمر NINCDS-ADRDA برای تشخیص در سال 1984 را مقرر نمودند ، که به طور جامع و گسترده در سال 2007 به روز شد. این معیارها و ضوابط نیازمند حضور اختلال شناختی و یک سندرم تایید هیستوپاتولوژیک از جمله آزمایش میکروسکوپی بافت مغز به تشخیص قطعی نیاز می باشد. اعتمادپذیری و اعتبار آماری خوب بین معیارها و ضوابط تشخیصی و تایید هیستوپاتولوژیکی قطعی نشان داده شده است. هشت حوضه ی شناختی عموما در حافظه ، زبان ، مهارت های ادراکی ، توجه ، توانایی ها و قابلیت های سازنده ، جهت یابی ، قابلیت های حل مشکل و عمکلردی آسیب می بینند. این حوضه ها معادل با معیارها و ضوابط NINCDS-ADRDA فهرست شده در دستورالعمل آماری و تشخیصی اختلالات ذهنی منتشر شده توسط انجمن روانپزشکی آمریکا می باشند.
تکنیک ها:
آزمون های روان شناختی عصبی مانند بررسی وضعیت مینی منتال(MMSE) ، به صورت گسترده برای ارزیابی اختلالات شناختی مورد نیاز برای تشخیص استفاده می شوند. آرایه های تست جامع تر برای اعتماد پذیری بالای نتایج ، علی الخصوص در مراحل اولیه ی بیماری ضروری می باشند. معاینه ی نورولوژیکی در اوایل بیماری آلزایمر معمولا نتایج نرمال را بجز برای اختلال شناختی آشکار فراهم می کند که ممکن است متفاوت از دیگر روندهای بیماری از جمله علل دیگر زوال عقل یا دمانس نباشد.
معاینات و ارزیابی های نورولوژیکی بیشتری در تشخیص افتراقی بیماری آلزایمر و بیماری های دیگر ضروری می باشد. مصاحبه با اعضای خانواده نیز در ارزیابی بیماری استفاده می گردد. افراد مراقبت کننده می توانند اطلاعات مهمی در مورد توانایی های روزمره ی زندگی همچنین در مورد کاهش ، تکرار عملکرد ذهنی فرد در اختیار بگذارند. دیدگاه فرد مراقبت کننده به خصوص مهم است ، زیرا فرد مبتلا به آلزایمر عموما بی خبر از نقائص خود می باشد. بسیاری اوقات ، خانواده ها نیز مشکلاتی را در شناسایی و تشخیص علایم زوال عقل اولیه دارند و ممکن است اطلاعات دقیقی را به پزشک منتقل نکنند.
یکی دیگر از نشانه های بیرونی و آشکار بیماری ، آنالیز مایع نخاعی برای پروتئین های آمیلوئید بتا و تاو می باشد ، جستجوی این پروتئین ها با استفاده از یک تپ اسپینال می تواند شروع آلزایمر را با حساسیت بین 94 تا 100 درصد پیش بینی نماید. زمانی که با تکنیک های تصویربرداری سیستم عصبی استفاده گردند ، پزشکان قادرند بیماران مبتلا به افت شدید حافظه را که گرفتار بیماری می باشند را شناسایی کنند. آزمایشات مایع نخاعی به صورت تجاری ، بر خلاف آخرین تکنولوژی تصویربرداری عصبی در دست هستند. بیماری آلزایمر در یک سوم از افرادی که هیچ علایمی در مطالعه ی سال 2010 نداشتند تشخیص داده شد ، به این معنا که پیشرفت بیماری به خوبی پیش از آنکه علایم بروز نماید روی می دهد.
آزمایش و تست مکمل که اطلاعات اضافی در برخی از ویژگی های بیماری را فراهم می کنند به منظور ردکردن دیگر تشخیص ها استفاده می شود. آزمایشات خون می توانند دیگر علل دمانس را نسبت به علل بیماری آلزایمر که ممکن است در موارد نادر قابل برگشت باشد فراهم نمایند. انجام آزمایشات عملکرد تیروئید ، ارزیابی B12 ، رد سفلیس ، رد کردن مشکلات متابولیکی (ازجمله برای آزمایشات عملکرد کلیه ، سطوح الکترولیت و دیابت) ، ارزیابی سطح فلزات سنگین(مانند سرب ، جیوه) و کم خونی یا آنمی. همچنین رد کردن هذیان گویی نیز ضروری است.
آزمایشات روان شناسی برای افسردگی به کار برده می شوند ، زیرا افسردگی می تواند همزمان با بیماری آلزایمر ، علامت اولیه ی اختلال شناختی ، یا حتی ایجاد بیماری باشد.
رادیولوژی یا تصویربرداری:
زمانی که به عنوان یک ابزار تشخیصی در دسترس باشد ، توموگرافی کامپیوتری گسیل تک فوتون(مقطع نگاری رایانه ای با نشر تک فوتون)(SPECT) و توموگرافی گسیل پوزیترون یا پت اسکن(PET) برای تایید نمودن تشخیص آلزایمر در ارتباط با ارزیابی های شامل بررسی وضعیت ذهنی استفاده می شوند. در فردی که در حال حاضر دچار دمانس می باشد ، SPECT ، به نظر می رسد که در افتراق بیماری آلزایمر از علل دیگر ممکن در مقایسه با استفاده از تست ذهن و آنالیز سابقه ی پزشکی بیمار ارجح باشد. پیشرفت ها به پیشنهاد معیارها و ضوابط تشخیصی جدید انجامیده است.
یک تکنیک جدید به نام PiB PET به منظور تصویربرداری مستقیم و واضح از رسوبات آمیلوئید بتا در داخل بدن با استفاده از یک ردیاب که به طور انتخابی به رسوبات آمیلوئید بتا متصل می شود توسعه یافته است. کامپوند Pib-PET از پت اسکن کربن 11 استفاده می کند. مطالعات اخیر نشان می دهند که PiB-PET در پیش بینی افراد مبتلا به اختلال شناختی خفیف که در عرض دو سال مبتلا به آلزایمر خواهند شد 86 درصد دقیق می باشد و در رد نمودن احتمال ابتلا به آلزایمر 92 درصد دقیق است.
ام آر آی می تواند تغییرات در اندازه ی نواحی مغز را شناسایی نماید. اندازه گیری این نواحی که آتروفی در حین پیشرفت بیماری آلزایمر نشان دهنده ی امید به عنوان یک شاخص تشخیصی می باشد. آن ممکن است نسبت به دیگر روشهای تصویربرداری یا رادیولوژی که در حال حاضر تحت مطالعه می باشند کم هزینه تر باشد.
پیشگیری:
در حال حاضر ، هیچ شواهد قطعی وجود ندارد که هرگونه ارزیابی خاص که در پیشگیری از بیماری آلزایمر موثر باشد را پشتیبانی کند. مطالعات گسترده ی اقدامات جلوگیری یا به تاخیر انداختن شروع بیماری آلزایمر اغلب نتایج ضد و نقیضی را ایجاد نموده است. با اینحال ، مطالعات اپیدمیولوژیک ارتباطاتی را بین فاکتورهای قابل دگرش معین از جمله برنامه ی غذایی ، خطر بیماری های قلبی عروقی ، فراورده های دارویی ، یا فعالیت های ذهنی در بین سایرین و احتمال جمعیتی ابتلای به بیماری آلزایمر را پیشنهاد نموده اند. تنها تحقیقات بیشتر ازجمله آزمایشات بالینی نشان خواهند داد که آیا این فاکتورها در پیشگیری از بیماری قادر به کمک می باشند یا نه.
اگرچه فاکتورهای ابتلای به بیماری های قلبی عروقی ، مانند افزایش کلسترول خون ، فشار خون بالا ، دیابت ، و استعمال دخانیات ، با خطر بالاتری از شروع و دوره ی بیماری آلزایمر همراه می باشند ، استاتین ها ، که داروهای پایین آورنده ی کلسترول هستند ، در پیشگیری یا بهبود دوره ی بیماری موثر نبوده اند. رژیم غذایی مدیترانه ای ، که شامل میوه و سبزیجات ، نان ، گندم ، و سایر غلات ، روغن زیتون ، ماهی ، و شراب قرمز است ، همگی به صورت جداگانه یا باهم می توانند ابتلا و دوره ی بیماری آلزایمر را کاهش دهند. اثر سودمند قلبی عروقی آن به صورت مکانیسم اقدام پیشنهاد گردیده است. شواهد محدودی در دست است که استفاده از شراب ضعیف تا متوسط الکل ، خصوصا شراب قرمز ، با خطر کمتری از ابتلا به بیماری آلزایمر همراه می باشد.
بررسی ها در مورد استفاده از ویتامین ها پی به شواهد کافی اثر بخشی پیشنهاد کردن ویتامین C ، E ، یا اسید فولیک همراه و بدون ویتامین B12 ، به عنوان عوامل پیش گیرنده یا درمان در بیماری آلزایمر نبرده اند. به علاوه ویتامین E با خطرات سلامتی مهمی در ارتباط است. آزمایشات بررسی کننده ی اسید فولیک(B9) و سایر ویتامین های خانواده ی B موفق به نشان دادن هیچ گونه ارتباط چشمگیری با زوال شناختی نشدند. اسید دوکوساهگزائنوئیک ، اسید چرب امگا 3 ، در کند کردن زوال عقل پی برده نشده است
استفاده ی طولانی مدت از داروهای ضد التهابی غیر استروئیدی(NSAIDs) مرتبط با کاهش احتمال پیشرفت بیماری آلزایمر می باشد. مطالعات بعد از مرگ انسان ، در مدل های حیوانی ، یا در بررسی های آزمایشگاهی نیز از این عقیده پشتیبانی می کنند که داروهای ضد التهابی غیر استروئیدی می توانند التهاب مربوط به پلاک های آمیلوئیدی را کاهش دهند. با اینحال آزمایشات بررسی کننده ی استفاده ی آنها به عنوان درمان تسکینی موفق به نشان دادن نتایج مثبت و قطعی در حالیکه هیچ آزمایش پیشگیری تکمیل شده است نشدند.
کورکومین از زردچوبه ی ، اثربخشی در پیشگیری از آسیب مغزی در مدل های موش به دلیل خواص ضد التهابی آن را نشان داده است.
افرادی که در فعالیت های ذهنی مانند مطالعه ، بازی های روی تخته(مانند شطرنج) ، انجام جدول کلمات ، نواختن آلات موسیقی ، یا تعامل اجتماعی منظم شرکت می کنند کاهش ابتلا به بیماری آلزایمر را نشان می دهند.
ماری جوانای دارویی به نظر می رسد که در به تاخیر انداختن بیماری آلزایمر موثر باشد. ماده ی فعال در ماری جوانا ، THC از تشکیل رسوبات در مغز در ارتباط با بیماری آلزایمر جلوگیری می نماید. THC ، پی برده شد که بازدارنده ی استیل کولین استراز موثرتر از داورهای تجاری عرضه شده در بازار باشد. THC همچنین پی برده شد که ایجاد آمیلوئید را کند می نماید.
برخی مطالعات نشان داده اند که افزایش خطر ابتلا به آلزایمر با فاکتورهای محیطی مانند مصرف فلزات ، خصوصا آلومینیوم ، یا قرارگیری در معرض حلال ها همراه باشد. کیفیت برخی از این مطالعات مورد انتقاد قرارگرفته و سایر مطالعات به این نتیجه رسیده اند که هیچ ارتباطی بین این عوامل محیطی و پیشروی آلزایمر وجود ندارد.
استعمال دخانیات یک فاکتور مهم در ابتلا به آلزایمر است. نشانگرهای سیستماتیک سیستم ایمنی بدن فاکتورهای ابتلا برای بیماری آلزایمر با تظاهر دیرهنگام می باشد.
کنترل بیماری:
هیچ علاجی برای بیماری آلزایمر وجود ندارد ؛ درمان های موجود کمک نشانه ای نسبتا کوچکی را ارائه می نمایند اما در ماهیت مسکن و تسکین دهنده باقی می مانند. درمان های فعلی را می توان به انواع دارویی ، روان شناسی و مراقبت تقسیم نمود.
داروشناسی:
در حال حاضر چهار دارو توسط سازمان های نظارتی مانند سازمان غذا و داروی آمریکا(FDA) و سازمان پزشکی اروپا(EMA) برای درمان علایم شناختی بیماری آلزایمر تایید شده اند: سه بازدارنده یا مهارکننده ی استیل کولین و ممانتین.
کاهش در فعالیت نورون های کولینرژیک یکی از ویژگی های شناخته شده ی بیماری آلزایمر است. بازدارنده های استیل کولین استراز به منظور کاهش در میزان آبکافت استیل کولین(Ach) بکار گرفته می شوند ، از اینرو غلظت استیل کولین را در مغز افزایش داده و به مصاف کاهش استیل کولین ایجاد شده توسط تخریب نورون های کولینرژیک می روند. تا سال 2008 ، بازدارنده های کولینرژیک که برای کنترل علایم بیماری آلزایمر تایید شدند شامل دانپزیل(نام تجاری آریسپت) ، گالانتامین(رازادین) و ریواستیگمین(یا اکسلون) می باشند. استیل کولین استراز یا کولین استراز آنزیمی است که استیل کولین را که برای تحریک اعصاب لازم است در محل سیناپس آبکافت می کند.
شواهدی برای اثربخشی این داروها در بیماری آلزایمر با شدت خفیف تا متوسط و برخی شواهد برای استفاده ی آنها در مرحله ی پیشرفته وجود دارد. تنها دانپزیل برای درمان زوال عقل بیماری آلزایمر پیشرفته تایید شده است. استفاده از این داروها در اختلال شناختی خفیف هیچ گونه اثری در تاخیر تظاهر بیماری آلزایمر نشان نداده اند. شایع ترین عوارض جانبی شامل تهوع و استفراغ است ، هر دوی آنها به مازاد کولینرژیک مرتبط می باشند. این عوارض جانبی در حدود 10 تا 20 درصد از مصرف کنندگان به وجود می آیند و از لحاظ شدت خفیف تا متوسط می باشند. عوارض ثانویه کم شایع تر شامل گرفتگی عضلانی ، کاهش ضربان قلب ، کاهش اشتها و وزن و افزایش تولید اسید معده است.
گلوتامات یک انتقال دهنده ی عصبی محرک سودمند برای سیستم عصبی است ، اگرچه مقادیر بیش از حد آن در مغز می تواند از طریق فرایندی به نام اکسی تاکسی سیتی به مرگ سلول بیانجامد که شامل انگیزش بیش از اندازه ی گیرنده های گلوتامات می باشد. اکسی تاکسی سیتی نه تنها در بیماری آلزایمر بروز می کند ، بلکه در دیگر بیماری های نورولوژیکی مانند بیماری پارکینسون و اسکلروز چندگانه یا ام اس نیز ظاهر می شود. ممانتین(اسامی تجاری آکاتینول ، آکسورا ، ابیکسیا/آبیکسیا ، ممکس و نمندا) ، یک آنتاگونیست گیرنده ی NMDA غیر رقابتی که اولین بار به عنوان یک عامل ضد آنفلونزا بکار برده شد.
ممانتین بر روی سیستم گلوتاماترژیک با مسدود نمودن گیرنده های NMDA و مهار نمودن انگیزش بیش از حد آنها توسط گلوتامات عمل می کند. ممانتین نشان داده است که به طور متوسط در درمان آلزایمر متوسط تا شدید موثر است. اثرات آن در مراحل ابتدایی بیماری آلزایمر نامشخص است. نتایج و اثرات سوء گزارش شده با ممانتین کمیاب و خفیف از قبیل توهمات ، سردرگمی ، سرگیجه ، سردرد و خستگی می باشند. ترکیب ممانتین و دانپزیل نشان داده است که از لحاظ آماری چشمگیر اما از لحاظ بالینی اثربخشی کم و ناچیزی دارد.
داروهای آنتی سایکوتیک در کاهش پرخاشگری و سایکوز یا روان پریشی در بیماران آلزایمر دارای مشکلات رفتاری نسبتا مفید هستند اما با عوارض بد شدیدی ، مانند اثرات عروقی مغزی ، مشکلات حرکتی یا زوال شناختی همراه می باشند. زمانی که در درازمدت استفاده شوند ، با افزایش مرگ همراه می باشند.
اگرچه داروهای فعلی نمی توانند آلزایمر را درمان یا از پیشروی آن جلوگیری کنند ، آنها ممکن است به کاهش علایم مانند از دست دادن حافظه و سرگیجه برای یک مدت محدود کمک کنند.
انواع داروها:
انجمن دارو و غذا ایالات متحده(FDA) دو نوع از داروها ، بازدارنده های استیل کولین(Aricept ، Exelon ، Razadyne ، Cognex) و ممانتین یا نمندا برای درمان علایم شناختی(از دست دادن حافظه ، سرگیجه ، و مشکلات در فکر کردن و استدلال کردن) بیماری آلزایمر را به اثبات رسانیده اند.
با پیشرفت آلزایمر ، سلول های مغز می میرند و اتصالات بین سلول ها از بین می رود ، باعث می شود تا علایم شناختی بدتر شوند. با وجود آنکه داروهای فعلی نمی توانند آسیب بیماری آلزایمر به سلول های مغز را متوقف کنند ، اما می توانند در کاهش دادن و تثبیت کردن علایم برای یک مدت محدود با اثر کردن بر روی مواد شیمیایی خاص درگیر شده در پیام های حامل در بین سلول های عصبی مغز کمک نمایند. پزشکان گاهی اوقات هر دو دارو را با هم تجویز می کنند. بعضی از پزشکان نیز دوز بالایی از ویتامین E را برای تغییرات شناختی بیماری آلزایمر تجویز می کنند.
داروهای مراحل اولیه تا متوسط بیماری:
تمامی داروهای تجویزی که در حال حاضر برای درمان علایم بیماری در مراحل اولیه تا میانی تایید شده اند ، رده ای از داروها بنام بازدارنده های کولین استراز می باشند. بازدارنده های کولین استراز به منظور درمان علایم مربوط به حافظه ، فکر کردن ، تکلم و بیان ، قضاوت و دیگر فرایندهای تصور شده تجویز می شوند.
بازدارنده های کولین استراز:
1-از کاهش یافتن و از دست رفتن استیل کولین ، پیام رسان شیمیایی مهم برای یادگیری و حافظه جلوگیری می نماید. این ارتباط بین سلول های عصبی را با بالا نگه داشتن سطوح استیل کولین تقویت می کند.
2- بدتر شدن علایم به مدت 6 تا 12 ماه ، به طور میانگین ، برای حدود نیمی از افرادی که از آنها مصرف کردند را کند می سازند.
3- بازدارنده های کولین استراز به طور کلی مقاوم می باشند. چنانچه عوارض جانبی بروز کنند ، آنها معمولا شامل تهوع ، استفراغ ، از دست دادن اشتها و افزایش حرکات شکمی می باشند.
پیش از شروع یک داروی جدید ، مطمئن شوید که پزشک شما و داروساز از تمامی داروهایی که در حال حاضر مصرف می کنید آگاه باشند. مهم است که از داروهایی که با فرد دیگری واکنش نخواهند داد و عوارض جانبی ایجاد نمی کنند اطمینان حاصل کنید.
سه بازدارنده ی کولین استراز معمولا تجویز می شوند:
-دانپزیل برای درمان تمامی مراحل بیماری آلزایمر تایید می شود.
-ریواستگمین یا اکسلون برای درمان آلزایمر خفیف تا متوسط تایید می شود.
-گالانتامین یا رازادین برای درمان آلزایمر خفیف تا متوسط تایید می شود.
تاکرین یا کوگنکس اولین بازدارنده ی کولین استرازی بود که تایید شد. پزشکان به ندرت آن را امروزه تجویز می کنند زیرا آن همراه با عوارض جانبی شدیدتری نسبت به سه داروی دیگر در این رده می باشد.
داروهای مراحل متوسط تا شدید بیماری:
نوع دوم دارو ، ممانتین یا نمندا توسط FDA برای درمان بیماران با آلزایمر متوسط تا شدید تایید می شود.
ممانتین به منظور بهتر کردن حافظه ، دقت ، استدلال ، زبان و تکلم و توانایی انجام کارهای ساده تجویز می گردد. آن می تواند به تنهایی یا همراه با دیگر درمان های آلزایمر استفاده شود. چندین شواهد وجود دارد که بیماران با آلزایمر متوسط تا شدید که بازدارنده ی کولین استراز را مصرف می نمایند ممکن است با مصرف ممانتین نیز بهره مند شوند. دانپزیل یا آریسپت تنها بازدارنده ی کولین استراز تایید شده برای درمان تمامی مراحل بیماری از جمله متوسط تا شدید می باشد.
-ممانتین فعالیت گلوتامات ، ماده ی شیمیایی پیام رسان مربوطه در حافظه و یادگیری ، را تنظیم می کند.
-ممانتین بدترشدن علایم بیماری را برای برخی افراد به طور موقت کند می کند. کارشناسان بسیاری فواید آن را مشابه بازداردنده های کولین استراز در نظر می گیرند.
-ممانتین می تواند عوارض جانبی از جمله سردرد ، یبوست ، سرگیجه و سردرگمی را ایجاد نماید.
ویتامین E:
پزشکان گاهی اوقات ویتامین E را برای درمان علایم آلزایمر شناختی تجویز می کنند. هیچ کسی نبایستی ویتامین E را برای درمان بیماری آلزایمر به جز تحت نظارت پزشک مصرف نماید.
ویتامین E یک آنتی اکسیدان می باشد ، ماده ای که ممکن است از سلول های مغز و دیگر بافت های بدن محافظت کند. استفاده از آن در بیماری آلزایمر اساسا بر مبنای مطالعه ای در سال 1997 است که نشان می دهد دوزهای بالا از دست دادن توانایی انجام فعالیت های روزانه و قرارگیری در محل مراقبت مسکونی به مدت چند ماه را به تاخیر می اندازد. آن مطالعه توسط ADCS ، کنسرسیوم تحقیقات بالینی انستیتو ملی در مورد پیری(NIA) انجام گرفت. از زمان انجام مطالعه ی ADCS ، محققین به شواهدی در مطالعات دیگر پی بردند که ویتامین E با دوز بالا می تواند خطر مرگ را خصوصا برای مبتلایان بیماری انسداد سرخرگ قلب به آرامی افزایش دهد.
ویتامین E خصوصا در دوزهای بالا در مطالعه ی ADCS استفاده شد می تواند با دیگر داروها تاثیر متقابلی داشته باشد ، از جمله داروهایی که برای جلوگیری از لخته شدن خون یا پایین آوردن کلسترول تجویز شدند.
مداخله ی روانی-اجتماعی:
فضای طراحی شده ی ویژه به منظور درمان هماهنگی حسی ، بنام اسنوزلن ، یک مداخله ی روانی اجتماعی جهت دار احساس برای افراد مبتلا به زوال عقل می باشد.
مداخلات روانی- اجتماعی:
مداخلات روانی اجتماعی به عنوان کمکی در درمان دارویی استفاده می شوند و می توانند در روشهای رفتاری ، احساس ، شناخت ، یا تحریک تقسیم بندی می شوند. تحقیقات بر روی اثربخشی در دسترس نبوده و به ندرت خاص بیماری آلزایمر است ، که بجای دمانس به صورت کلی توجه می نمایند.
مداخلات رفتاری تلاش می کنند تا سوابق و عواقب رفتارهای مشکل را شناسایی و کاهش دهند. این روش در بهبود عملکرد کلی موفقیتی را نشان نداده است ، اما می تواند در کاهش برخی از عملکردهای مشکل مانند بی اختیاری کمک نماید. داده ها و اطلاعات با کیفیت بالای ناکافی در مورد اثربخشی این تکنیک ها در دیگر مشکلات رفتاری مانند سرگردانی وجود دارد.
مداخلات احساس گرا از جمله درمان خاطره ، درمان اعتبارسنجی ، روان درمانی حمایتی ، هماهنگی حسی ، نیز اسنوزلن نامیده می شوند و درمان حضور شبیه سازی شد. روان درمانی حمایتی مطالعه ی علمی رسمی کمی را دریافت نموده است اما برخی از پزشکان آن را در کمک به بیماران با اختلال خفیف در تنظیم بیماری شان مفید می دانند. درمان به خاطر آوری و یادآوری(RT) شامل بحثی از تجربیات گذشته به صورت فردی یا گروهی است که چندین بار با کمک از عکس ها ، آیتم های خانگی ، ثبت و سوابق موسیقی و صدا یا دیگر موارد آشنا از گذشته می باشند.
هدف از درمان های شناخت گرا ، که شامل جهت یابی واقعیت و آموزش مجدد شناختی می باشد ، کاهش نقائص شناختی است. جهت گیری واقعیت شامل ارائه ی اطلاعات در مورد زمان ، مکان یا فرد به منظور سهولت درک فرد درمورد محیط اطرافش و محل خود در آنها است. از سوی دیگر ، آموزش مجدد شناختی در تلاش است تا توانایی های آسیب دیده را بوسیله ی تمرین توانایی های ذهنی بهبود بخشد. هر دو برخی اثربخشی بهبود توانایی های شناختی را نشان داده اند ، اگرچه در بعضی مطالعات این تاثیرات گذرا و منفی مانند سرخوردگی بودند.
درمان های تحریک گرا شامل هنر ، موسیقی و درمان های خانگی ، ورزش و هر نوع دیگری از فعالیت های تفریحی می باشد. تحریک دارای پشتیبانی نسبتا کمی در بهبود رفتار ، خلق و خو و تا حد کمتری عملکرد می باشد. با این وجود ، همان اندازه که این تاثیرات مهم هستند ، پشتیبانی اصلی استفاده از درمان های تحریک تغییر در روال کار فرد است.
مراقبت از بیمار:
از آنجایی که بیماری آلزایمر هیچ علاجی ندارد و به تدریج موجب ناتوانی افراد در رسیدگی به نیازهایشان می شود ، مراقبت اساس درمان است و بایستی با دقت در طول دوره ی بیماری مدیریت شود.
در طول مراحل اولیه و متوسط ، تغییرات در محیط زندگی و سبک زندگی می توانند امنیت بیمار را افزایش داده و بار مراقب را کاهش دهند. نمونه هایی از چنین تغییرات پیرو و تبعیت از روال و شیوه های ساده است ، قرار دادن قفل های ایمنی ، برچسب گذاری اشیاء منزل برای یادآور شدن به فرد بیمار یا استفاده از اشیاء اصلاح شده و تغییر یافته ی زندگی روزمره. بیمار ممکن است همچنین در غذا خوردن ناتوان شود ، بنابراین آنها نیاز به غذا در قطعات کوچکتر دارند.
هنگام به وجود آمدن مشکلات بلعیدن ، استفاده از لوله های غذارسانی ممکن است لازم باشد. در چنین مواردی ، اثربخشی پزشکی و اخلاقیات غذارسانی مستمر یک مسئله ی مهم افراد مراقبت کننده و اعضای خانواده می باشد. بکارگیری موانع جسمی به ندرت در هر مرحله از بیماری نشان داده می شود ، اگرچه شرایطی وجود دارند که ضروری است تا از آسیب به فرد مبتلا به آلزایمر یا مراقبت کنندگان از او جلوگیری به عمل آید.
با پیشرفت بیماری ، مسائل مختلف پزشکی مانند بیماری دهان و دندان ، زخم های فشار ، سوء تغذیه ، مشکلات بهداشتی یا تنفسی ، یا عفونت های چشمی می توانند نمایان گردند. مدیریت دقیق می تواند جلوی آنها را بگیرد ، در حالیکه درمان حرفه ای هنگام بروز آنها ضروری است. در طول مراحل پایانی بیماری ، تمرکز درمان بر روی تسکین ناراحتی تا زمان مرگ قرار می گیرد.
مطالعه ی اخیر در ایالات متحد نشان داد ، بیمارانی که مراقبان آنها درک واقع بینانه ای از پیش شناخت و عوارض بالینی زوال عقل داشتند ، احتمال کمتری برای دریافت درمان پرخاشگری در نزدیکی پایان زندگی داشتند.
تشخیص مراحل اولیه ی بیماری آلزایمر مشکل می باشد. تشخیص قطعی معمولا زمانی انجام می پذیرد که اختلال شناختی یکبار فعالیت های روزمره ی زندگی را دربرگیرد ، اگرچه فرد ممکن است هنوز به طور مستقل زندگی کند. علایم از مشکلات شناختی خفیف مانند از دست دادن حافظه از طریق مراحل افزایش اختلالات شناختی و غیر شناختی ، با از بین بردن هر گونه احتمال زندگی مستقل پیشروی خواهند نمود.
امید به زندگی افراد مبتلا به بیماری کاهش می یابد. میانگین طول عمر پس از تشخیص در حدود هفت سال است. کمتر از 3 درصد از بیماران بیش از 14 سال زندگی می کنند.مشخصات بیماری به طور چشمگیر که با زنده ماندن در ارتباط هستند شامل افزایش شدت اختلال شناختی ، کاهش سطح عملکرد ، سابقه ی افتادن ، و نابسامانی هایی در ارزیابی نورولوژیکی می باشند. سایر بیماری های همزمان مانند مشکلات قلبی ، دیابت ، یا سابقه ی سوء مصرف الکل نیز با کاهش زنده ماندن مرتبط هستند. با وجود آنکه هرچه سن در شروع بیماری زودتر تر باشد سال های بقا بیشتر است ، امید به زندگی خصوصا هنگام مقایسه با افراد سالم در بین آنهایی که جوانتر هستند کاهش می یابد. مردان پیش شناخت مساعد کمتری نسبت به زنان دارند.
این بیماری علت اصلی مرگ در 70 از تمام موارد است. پنومونی و آب زدایی شایعترین علل فوری مرگ هستند در حالیکه سرطان علت کم شایعتر مرگ نسبت به جمعیت عمومی است.
شیوع و همه گیر شناسی:
دو معیار اصلی در مطالعات همه گیر شناسی استفاده می شوند: بروز و شیوع. بروز ، تعداد موارد جدید در هر واحد از شخص-زمان در معرض ابتلا(معمولا تعداد موارد جدید در هر هزاران نفر-سال) می باشد ، در حالیکه شیوع تعداد کل موارد بیماری در جمعیت در هر زمان داده شده است.
با توجه به بروز ، مطالعات طولی همگن(مطالعاتی که در ان افراد بدون بیماری در طول سال ها تقلید می شوند) میزانی بین 10 و 15 در هر هزاران نفر-سال برای تمامی دمانس ها و 5-8 برای آلزایمر می باشد ، به این معنا که نیمی از موارد دمانس جدید هر سال جزو بیماری از نوع آلزایمر می باشد. سن بالا یک عامل خطر اصلی برای بیماری و میزان بروز برای تمامی سنین یکسان نمی باشد. هر پنج سال بعد از سن 65 سالگی ، خطر ابتلای بیماری تقریبا به دو برابر می رسد ، افزایش از سه تا اندازه ی 69 در هر هزار نفر در سال است. همچنین تفاوت های جنسی نیز در میزان بروز بیماری وجود دارد ، زنان خطر ابتلای بالاتری از بیماری آلزایمر را خصوصا در افراد بالای 85 سال دارا هستند.