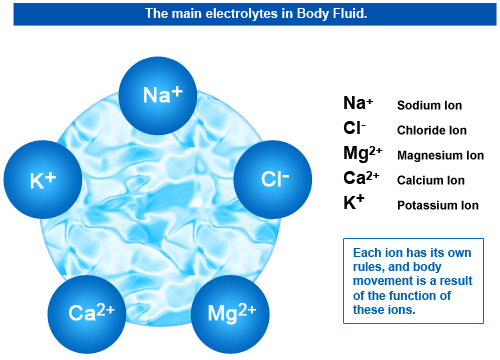
آب و الکترولیت ها

الکترولیت ماده ای است که با حل شدن در آب یک محلول رسانای الکتریکی می سازد. الکترولیت ها حامل بار بوده و برای زندگی موجودات زنده ضروری هستند. در بدن ما الکترولیت ها شامل سدیم (Na+ )، پتاسیم (K+ )، کلسیم (Ca2+ )، بی کربنات (HCO3- )، منیزیم (Mg2+ )، کلرید (C1- ) و فسفات هیدروژن (HPO42- ) هستند.
الکترولیت ها چه عملکردی دارند؟
الکترولیت ها عملکرد ماهیچه و اعصاب، هیدراتاسیون بدن، pH خون و فشار خون را تنظیم می کنند و وظیفه بازسازی بافت های آسیب دیده را بر عهده دارند. مکانیسم های زیادی در بدن ما وجود دارند که غلظت الکترولیت ها را تحت کنترل شدید در می آورند.
ماهیچه ها و نورون های عصبی بدن ما گاهی به عنوان بافت های الکتریکی بدن شناخته می شوند. این بافت ها به حرکت الکترولیت ها در مایع برون سلولی، درون سلولی و بین سلولی متکی هستند. (مایعی که درون، برون و میان سلول ها وجود دارد)
انجام انقباضات عضلانی نیاز به یون های کلسیم، سدیم و پتاسیم دارد. سطح نامناسب الکترولیت های بدن منجر به ضعف عضلانی یا انقباضات شدید ماهیچه ها می شود.
سلول های عصب و ماهیچه قلب برای حفظ ولتاژ در غشای سلولی و انتقال ایمپالس های الکتریکی به سلول های دیگر از الکترولیت ها استفاده می کنند.
سطح یک الکترولیت در خون می تواند بسیار بالا یا پایین باشد. وقتی میزان آب بدن تغییر می کند و سطح هیدراتاسیون بدن بالا یا پایین می رود، الکترولیت ها سعی در تعدیل این میزان دارند.
سطح الکترولیت توسط کلیه ها و بعضی از هورمون ها ثابت نگه داشته می شود. وقتی ورزش می کنیم عرق می کنیم و الکترولیت از دست می دهیم که اکثر آن سدیم و پتاسیم است.
برای ثابت نگه داشتن غلظت الکترولیت در مایعات بدن، باید با الکترولیت های جدید آنها را جایگزین کنیم. میوه های تازه و سبزیجات منابع خوب سدیم و پتاسیم هستند و جای خالی الکترولیت های از دست رفته را در بدن پر می کنند. اگر الکترولیت های ضروری بدن مصرف نشوند عواقبی برای سلامت فرد به دنبال خواهند داشت. شایع ترین نوع عدم تعادل، هایپرناترمی و هیپوناترمی (سدیم بیش از اندازه یا بسیار کم) و هایپر کالمی و هیپوکالمی (پتاسیم بیش از حد و بسیار کم) است.
پسوند هیپو نشان دهنده کم بودن و هایپر نشان دهنده ازدیاد یک ماده است.
اندازه گیری آب کل بدن:
از آب رادیواکتیو (تریتیوم، H2O) یا آب سنگین (دوتریم، H2O) می توان برای اندازه گیری آب کل بدن استفاده کرد.
اندازه گیری حجم مایع خارج سلولی:
حجم مایع خارج سلولی را می توان با استفاده از هر ماده ای که در پلاسما و مایع میان بافتی توزیع می گردد، اما به آسانی در غشای سلول نفوذ نمی کند برآورد کرد. از جمله این مواد می توان به سدیم رادیواکتیو (Na)، کلر رادیواکتیو، I-یوتالامات، یون تیوسولفات و اینولین هستند.
اندازه گیری حجم پلاسما:
برای اندازه گیری حجم پلاسما باید ماده ای استفاده شود که که نتواند به آسانی در غشاهای مویرگی نفوذ کند اما بعد از تزریق در سیستم عروقی باقی بماند. یکی از موادی که بیشترین کاربرد را برای اندازه گیری حجم پلاسما دارد، آلبومین سرم نشان دار شده با ید رادیواکتیو (I-albumin) است. همچنین رنگ هایی مانند آبی اوانس (T-1824) که به پروتئین های پلاسما می چسبد نیز می توانند برای اندازه گیری حجم پلاسما مورد استفاده قرار گیرند.
اندازه گیری حجم خون:
برای اندازه گیری حجم خون می توان از تزریق گلبول های قرمز نشان دار شده با ماده رادیواکتیو استفاده کرد. بعد از این که این مواد در گردش خون مخلوط شدند می توان رادیواکتیویته نمونه خون مخلوط را اندازه گیری و با استفاده از اصل رقیق سازی، حجم کل خون را محاسبه کرد. ماده ای که اغلب برای نشان دار کردن گلبول های قرمز مورد استفاده قرار می گیرد، کروم رادیو اکتیو (Cr) است که به طور محکم به گلبول های قرمز متصل می گردد.
تخمین میزان فیلتراسیون گلومرولی (GFR):
برای اندازه گیری GFR از آزمایش کلیرانس استفاده می شود. کلیرانس کلیوی یک ماده حجمی از پلاسما (بر حسب میلی لیتر) است که در هر دقیقه به طور کامل به وسیله کلیه ها از آن ماده پاک می شود. میزان فیلتراسیون گلومرولی در حالت طبیعی، 125 میلی لیتر در دقیقه یا 180 لیتر در روز است.
اگر ماده ای به صورت آزادانه فیلتره شود و به وسیله توبول های کلیه بازجذب یا ترشح نشود، میزان دفع ادراری آن برابر با میزان فیلتراسیون آن ماده در کلیه می باشد. ماده ای که واجد این شرایط باشد اینولین است. اینولین در بدن تولید نمی شود و برای اندازه گیری GFR باید به صورت داخل وریدی تجویز شود. کلیرانس اینولین روش استاندارد اندازه گیری GFR است.
کراتی نین تقریبا به طور کامل به وسیله فیلتراسیون گلومرولی از مایعات بدن پاک می شود. بنابراین کلیرانس کراتی نین نیز می تواند برای ارزیابی GFR مورد استفاده قرار گیرد. چون اندازه گیری کلیرانس کراتی نین نیاز به تزریق داخل وریدی به
بیمار ندارد، این روش از نظر بالینی بیشتر از کلیرانس اینولین برای تخمین GFR مورد استفاده قرار می گیرد. با این حال چون مقدار اندکی از کراتی نین به وسیله توبول ها ترشح می شود، لذا مقدار کراتی نین دفع شده مختصری بیشتر از مقدار فیلتره شده است.
از کلیرانس سیستاتین C نیز جهت اندازه گیری GFR استفاده می شود. این ترکیب یک پروتئین کوچک با وزن مولکولی 13 کیلودالتون است که باعث مهار سیستئین پروتئازها می شود. این پروتئین به دلیل کوچک بودن و داشتن بار مثبت به طور کامل و آزادانه از گلومرول ها فیلتره شده و سپس بدون آن که از توبول ها ترشح شود، تقریبا به طور کامل بازجذب شده و توسط توبول های کلیوی شکسته می شود. سنجش این ماده در خون میزان فیلتراسیون گلومرولی کلیه را نشان می دهد، بنابراین شاخص مناسبی برای اندازه گیری GFR است.
تخمین جریان جریان پلاسمای کلیه:
از نظر تئوری اگر ماده ای به طور کامل از پلاسما پاک شود، میزان کلیرانس آن ماده برابر با میزان کل جریان پلاسمای کلیه می باشد. در عمل ماده ای که به طور کامل از کلیه ها پاک شود شناخته نشده است. اما یک ماده به نام پاراآمینوهیپوریک اسید (PAH)، حدود 90 درصد از کلیه ها پاک می شود. بنابراین کلیرانس PAH می تواند به عنوان تخمینی از جریان پلاسمای کلیه مورد استفاده قرار گیرد.
آلدوسترون:
رنین با تجزیه یک پیوند پپتیدی بین دو ریشه لوسین در انتهای کربوکسیل آنژیوتانسینوژن (a2-گلوبولین که در کبد سنتز می شود) تولید دکاپپتید آنژیوتانسین 1 می کند. آنزیم مبدل آنژیوتانسین (ACE)، گلیکوپروتئینی که بر روی سطح اندوتلیال عروق کلیه و ریه وجود دارد، با برداشت دی پپتید (Leu-His) انتهای آمینو (تجزیه پیوند بین Phe و His) از آنژیوتانسین 1، آن را به اکتاپپتید آنژیوتانسین 2 تبدیل می کند. آنژیوتانسین 2 باعث تولید و ترشح آلدوسترون و همچنین انقباض شریانچه ها می شود. افزایش غلظت یون پتاسیم مایع خارج سلولی به میزان زیادی ترشح آلدوسترون را افزایش می دهد. کاپتوپریل و الاناپریل به عنوان مهار کننده های رقابتی ACE، در درمان فشار خون مورد استفاده قرار می گیرند.
آلدوسترون با تحریک پمپ سدیم-پتاسیم ATPase در سمت قاعده ای-جانبی سلول های اصلی توبول های جمع کننده قشری نفرون ها، بازجذب سدیم را افزایش و هم زمان ترشح پتاسیم را افزایش می دهد. آلدوسترون نفوذپذیری سمت مجرایی غشاء به سدیم را نیز افزایش می دهد. آلدوسترون همچنین موجب ترشح یون های هیدروژن در تبادل با سدیم در سلول های بینابینی (اینترکاله) توبول های جمع کننده قشری می شود.
تنها حدود 60 درصد آلدوسترون در گردش خون با میل ترکیبی کم به آلبومین و ترانس کورتین متصل می شود و حدود 40 درصد آن به شکل آزاد می باشد.
سندرم کان (Conns syndrome) نوعی هیپرآلدوسترونیسم اولیه است که به علت تومور در سلول های ناحیه گلومرولوزا ایجاد می شود. مهم ترین اثرات آن هیپوکالمی، افزایش مختصر حجم مایع خارج سلولی و حجم خون، افزایش بسیار ناچیز سدیم پلاسما و تقریبا همیشه هیپرتانسیون است. کاهش غلظت رنین پلاسما یکی از معیارهای تشخیصی هیپرآلدوسترونیسم اولیه است. این امر ناشی از سرکوب فیدبکی ترشح رنین بر اثر آلدوسترون اضافی است. در هیپرآلدوسترونیسم ثانویه که ممکن است به علت بیماری های کلیوی ایجاد شود، افزایش سطح آنژیوتانسین و رنین پلاسما دیده می شود.
بعضی از بیماران (معمولا کودکان) در صورت افزایش ترشح آلدوسترون، علائمی چون افزایش فشار خون، هیپوکالمی و مهار سیستم رنین-آنژیوتانسین را نشان می دهند. اگر آزمایش پلاسما و ادرار، وجود مقادیر افزایش یافته مینرالوکورتیکوئید را نشان دهد، گفته می شود که این بیماران به سندرم افزایش ارثی مینرالوکورتیکوئید (AME) هستند. این سندرم در نتیجه نقص در غیر فعال سازی کورتیزول به وسیله 11 بتا-هیدروکسی استروئید دهیدروژناز است. اگر میزان پلاسمای کورتیزول 100 برابر بیشتر از میزان آلدوسترون باشد، کورتیزول گیرنده مینرالوکورتیکوئیدی کلیه را اشباع کرده و در نتیجه موجب احتباس سدیم و مهار محور آلدوسترون-آنژیوتانسین-رنین می شود.
فرم دیگری از این سندرم نیز جود دارد که ناشی از کمبود ارثی ایزومر 11 بتا-هیدروکسی استروئید دهیدروژناز است و با خوردن مقدار زیادی شیرین بیان تظاهر می یابد. ترکیبات اصلی شیرین بیان، گلیسرهیزیک اسید و گلیسرهتینیک اسید (GE)، مهار کننده قوی 11 بتا-هیدروکسی استروئید دهیدروژناز است. با بلوکه شدن فعالیت این آنزیم غیر فعال کننده، GE اتصال کورتیزول به گیرنده های مینرالوکورتیکوئید و بنابراین القاء سندرم AME را تسهیل می کند.
در افزایش فشار خون، به خصوص افزایش فشار خون همراه با مسمومیت حاملگی (اکلامپسی)، سیستم رنین-آنژیوتانسین و گیرنده آلدوسترون دخالت دارد. افزایش فشار خون در حدود 6% از حاملگی ها اتفاق می افتد که برخی از این موارد، به دلیل موتاسیون گیرنده های مینرالوکورتیکوئید و جایگزینی سرین موقعیت 810 با اسیدآمینه سرین (به صورت موتاسیون S810 نوشته می شود) می باشند. در شکل موتانت گیرنده، پروژسترون به صورت آگونیست عمل کرده و بازجذب یون های سدیم از کلیه را القاء می کند.
هورمون آنتی دیورتیک (ADH):
کاهش موثر حجم خون یا افزایش اسمولاریته مایع خارج سلولی، ترشح ADH را تحریک می کنند، اما ADH حساسیت خیلی بیشتری به تغییر اندک اسمولاریته در مقایسه با تغییرات مشابه در حجم خون دارد. این هورمون که وازوپرسین نیز نامیده می شود، از طریق اتصال به گیرنده V2 خود در غشای سلول های توبول های دیستال انتهایی، توبول های جمع کننده قشری و مجاری جمع کننده مرکزی نفرون ها و تحریک آدنیلات سیکلاز، باعث افزایش منافذ آکوآپورین 2 (AQP-2) در این سلول ها و نفوذپذیری آن ها به آب می شود. وازوپرسین همچنین از طریق اتصال به گیرنده V1 خود در غشای سلول های عضله صاف عروقی و تحریک فسفولیپازC ، موجب انقباض عروقی و افزایش فشار خون می شود. نیکوتین و مرفین موجب تحریک ترشح ADH می شوند. الکل و اپی نفرین موجب مهار ترشح ADH می شوند.
فاکتور دهلیزی دفع کننده سدیم (ANF):
این هورمون که پپتید دهلیزی دفع کننده سدیم (ANP) نیز نامیده می شود، با افزایش حجم خون و کشیدگی قلب، از دهلیزها ترشح می شود و با اثر بر روی سلول های گرانولوزای قشر فوق کلیه، ترشح آلدوسترون را مهار می کند. از طرف دیگر، ANF با اثر بر روی سلول های ژوگستای گلومرولی باعث کاهش ترشح رنین از این سلول ها می شود که در نتیجه آن سنتز آنژیوتانسین 2 و متعاقبا آلدوسترون کاهش می یابد. کاهش ترشح آلدوسترون موجب کاهش باز جذب کلیوی Na+ می شود.
گوانیلین:
گوانیلین، پپتیدی است که به وسیله سلول های جامی شکل روده (سلول های تولید کننده موسین) ترشح شده و عمدتا به لومن روده می ریزد. این ماده با اتصال به گیرنده های واقع بر سلول های حاشیه مسواکی روده، باعث فعال شدن گوانیلات سیکلاز و افزایش غلظت سیتوزولی cGMP شده و از این طریق ترشح NaCl را تحریک می کند.
اختلالات آب و الکترولیت ها:
هیپرناترمی:
کمبود ADH (دیابت بی مزه)، تعریق شدید، اسهال و یا استفراغ طولانی، هیپرآلدوسترونیسم، سندرم کوشینگ، کمبود حس تشنگی (disdipsia) به ویژه در افراد سالخورده و نوزادان، درمان دیابت با انسولین (انسولین گلوکز خون را کاهش داده و با کاهش اسمولاریته خون، حجم مایع خارج سلولی را کاهش می دهد).
هیپوناترمی:
مصرف بیش از حد دیورتیک ها (داروهای مدر)، پرآبی یا احتباس بیش از حد آب (هیدراتاسیون)، سندرم ترشح نامناسب ADH (SIADH)، تعریق شدید و طولانی، بیماری آدیسون، اسیدوز متابولیک، کتواسیدوز دیابتیک (به علت دفع سدیم با آنیون های آلی)، دیابت ملیتوس (در دیابت به علت وجود اسمولاریته بالا، آب از محیط داخل سلولی به فضای خارج سلولی منتقل می شود)، نارسایی های کلیوی مانند سندرم نفروتیک و اسیدوز توبولی (به علت اختلال در تبادل یون های سدیم و هیدروژن)، بیماری های قلبی (نارسایی احتقانی قلب)
هیپوکالمی:
تزریق انسولین (با فعال کردن پمپ سدیم-پتاسیم) یا گلوکز وریدی، افزایش آلدوسترون (سندرم کان)، تحریک بتا-آدرنرژیک (که با فعال کردن پمپ سدیم-پتاسیم، باعث ورود پتاسیم به داخل سلول می شود)، آلکالوز متابولیک، کاهش اسمولاریته خارج سلولی (به علت ورود پتاسیم از مایع خارج سلولی به داخل سلول ها)
هیپرکالمی:
دیابت قندی، بیماری آدیسون، مهار بتا-آدرنرژیک (مهار کننده های بتا-آدرنرژیک همچنین موجب کاهش ترشح رنین از کلیه می شوند که خود موجب کاهش ترشح آلدوسترون و ایجاد هیپرکالمی می شود)، اسیدوز متابولیک، لیز سلولی، فعالیت شدید عضلانی، اسیدوز توبولی، افزایش اسمولاریته خارج سلولی و دهیدراتاسیون سلولی (به علت ورود پتاسیم از سلول ها به مایع خارج سلولی)
هیپوکلرمی:
شامل عوامل ایجاد کننده هیپوناترمی به علاوه آلکالوز متابولیک می باشند.
برخی علل هیپرکلرمی:
شامل عوامل ایجاد کننده هیپرناترمی و اسیدوز متابولیک همراه با دفع بی کربنات می باشند.
شکاف آنیونی:
همواره آنیون ها و کاتیون های موجود در مایعات بدن با یکدیگر برابرند. به طور معمول تنها برخی یون ها (مانند سدیم، پتاسیم، کلر و بی کربنات) اندازه گیری می شوند. به تفاوت بین غلظت کاتیون ها (Na+ و K+) و آنیون ها (Cl- و HCO3-) در خون شکاف آنیونی گفته می شود. محدوده طبیعی شکاف آنیونی 8 تا 16 میلی اکی والان در لیتر و به طور متوسط 12 میلی اکی والان در لیتر می باشد. در اسیدوز لاکتیک و اسیدوز کتونی به دلیل تجمع آنیون هایی که اندازه گیری نمی شوند (لاکتات و اجسام کتونی)، شکاف آنیونی افزایش پیدا می کند.