تاریخچه و ویژگی های اساسی پاسخ های ایمنی
واژه ایمنی از کلمه لاتین(Immunitas) به معنی مصونیت سیاسی و اجتماعی گرفته شده که در روم باستان به سناتور های رومی در دوره نمایندگی آنها عطا می شد و از زمانهای بسیار قدیم کلمه ایمنی را برای مصونیت از ابتلا به بیماری های مختلف بخصوص بیماریهای عفونی به کار می بردند. همچنین واژه(Immunis) نیز به معنی معاف بودن از پرداخت مالیات بوده و کلاً در موارد مصونیت از هزینه های اجتماعی یا ابتلا به بیمار ی به کار می رفته است . مجموعه عواملی (سلول ها و مولکول هایی) که باعث ایجاد مصونیت در بدن می شود به نام سیستم ایمنی [1] و پاسخ هماهنگ و کامل آنها به مواد بیگانه به نام پاسخ ایمنی [2] نامیده می شود. اغلب مورخین معرفی مفهوم ایمنی برای اولین بار را به تاسیدیدیس [3] در یونان به پنج قرن قبل از میلاد نسبت می دهند زیرا این واژه را برای عفونتی که طاعون می نامند و احتمالا با طاعون خیارکی که امروزه می شناسیم ، تفاوت دارد ، بکار می برده است. چینیان باستان نیز برای جلوگیری از ابتلا به بیماری آبله ، کودکان را وادار به استنشاق پودر زخمهای پوستی بیماران بهبود یافته از آبله و یا تلقیح پوسته های خشک در زخمهای جلدی می کردند و برای نخستین بار اقدام به مصون سازی در برابر یک بیماری عفونی می نمودند .اخبار مربوط به این روش محافظت اطفال در برابر آبله به تدریج در طول مسیر کاروان آسیای مرکزی به سمت غرب گسترش یافته ودرنهایت به ترکیه رسید.درسال1718خانم مری ورتلی مونتاگو [4] نویسنده وهمسرسفیر کبیرانگلستان درقسطنطنیه تصمیم گرفت که این روش را در مورد کودکانش پیاده کند و انجام این عمل کودکان او را در برابر آبله مصون کرد . سپس اخبار این عمل به سرعت به انگلستان رسید و پس از اندکی مقاومت و در هنگام اپیدمی آبله به صورت یک روش معمول درآمد . این روش را واریو لاسیون [5] نامیدند . زیرا در زبان لاتین واریولا به معنی آبله است. در سال 1774 یک کشاورز انگلیسی به نام بنجامین جستی [6] از آبله گاوی به جای آبله انسانی برای واریو لاسیون کودکانش استفاده کرد و مشاهده نمود که این روش مؤثرتر است و موارد خفیف این بیماری نیز در این روش بندرت مشاهده می گردد، در حالی که مصون سازی با موفقیت همراه است ولی متا سفانه جستی موفق به انتشار کشف خود نشد تا اینکه در سال 1798 پزشکی به نام ادوارد جنر [7] این روش استفاده از آبله را از یکی از بیمارانش فرا گرفته و تصمیم گرفت در این مورد تحقیق نماید . پایه مطالعات جنر در ایده مسری بودن بیماریهای عفونی به تحقیقات دانشمندی به نام فراکسترو [8] در سال 1546 بر می گردد. او معتقد بود که بیماری مسری ، عفونتی است که از یک انسان به انسان یا از یک جاندار به جاندار دیگر منتقل می گردد و عامل این بیماری ها ذرات غیر قابل رویتی هستند که دیده نمی شوند . همچنین خود جنر مشاهده کرد که زنان و دخترا ن شیر دوشی که از بیماری خفیف گاوی بهبود می یابند هرگز به بیماری خطرناک آبله انسانی مبتلا نمی شوند. جنر با استفاده از عصاره پوسته های زخم آبله گاوی و تلقیح آن به بازوی دختر بچه هشت ساله ای به نام سارا نلمث [9] مصونیت ایجاد کرده و بعد از مدتی که این دختر بچه عمداً در برابر تلقیح آبله انسانی قرار گرفت به بیماری آبله مبتلا نشد . جنر این روش برتر را به سرعت جایگزین واریو لاسیون کرد و نام این عمل را واکسیناسیون [10] نامید زیرا در زبان لاتین (Vacca) به معنی گاو می باشد و در سال 1958 سازمان بهداشت جهانی تصمیم گرفت تا کوششی برای ریشه کن کردن بیماری آبله انجام دهد و انجام واکسیناسیون آبله بقدری مو فقیت آمیز بود که در سال 1980 آبله به عنوان اولین بیماری عفونی ریشه کن شده در سطح جهان معرفی گردید .با وجود اکتشاف جنر بنظر نمی رسید که روش واکسیناسیون برای سایر بیماریها نیز قابل تعمیم باشد و در نتیجه تا حدود صد سال پس از آن پیشرفت قابل ملاحظه ای در مورد واکسیناسیون صورت نگرفت تا اینکه در سال1879درفرانسه دانشمندی نابغه بنام لوئی پاستور [11] در هنگام مطالعه بر روی باکتری مولد بیماری وبای مرغی (پاستور لامولتی سیدا )به کشف تازه ای نائل گردید. او یک کشت تازه از این باکتری تهیه کرده بود وبا تزریق مقداری از آنها به مرغ ها باعث مرگ آنها می شد . مسئولیت این کار را به دستیارش آقای چارلز چمبرلند [12]سپرد ، اما ایشان به علت کمی وقت و مسافرت این کار را انجام نداده و به موقع بازگشت از مسافرت و بعد از چند هفته ، از این کشت ها که بر روی میز آزمایشگاه مانده بودند استفاده کرد و با کمال تعجب مشاهده کرد مرغها سالم و زنده ماندند .پاستور یک مقدار دیگر از کشت میکروبی تازه همین باکتری را به مرغها تزریق کرد و مشاهده کرد که هیچیک از آنها حتی به فرم خفیف بیماری نیز مبتلا نشدند . پاستور فورا متوجه شد که این پدیده از نظر اصول کلی مشابه تجربه جنر درباره آبله گاوی است ، زیرا او توانسته بود با تزریق مقداری از کشت کهنه باکتری ، مرغ ها را در برابر بیماری حاصل از کشت تازه همان ارگانیسم محافظت نماید .پس از این کشف مهم ، پاستور خواست تا اصل کلی را در مورد بیماری های دیگر نیز آزمایش کند . بنا براین پاستور در ابتدا یک واکسن علیه بیماری سیاه زخم که توسط (با سیلوس آنتراسیس) ایجاد می گردد تهیه کرد . پاستور در یافت که در مورد این با کتری گذشت زمان باعث از بین رفتن خاصیت بیماریزایی نمی شود بلکه برای این کار او می بایست باکتری را در حرارتی بیش از حد معمول کشت دهد . در حرارت 42ºC این باکتری خاصیت بیماریزایی خود را از دست داده ولی توانایی ایجاد محافظت گوسفندان ، بزها و گاوها را در برابر بیماری سیاه زخم دارد . وی چند سال بعد واکسن مؤثری علیه بیماری هاری تهیه کرد و بدین ترتیب پاستور اصول کلی واکسیناسیون و توانایی آن را برای محافظت علیه عوامل عفونت زا بیان داشت . از این رو لوئی پاستور را می توان بنیانگذار علم ایمنو لوژی بشمار آورد . پاستور علی رغم اینکه توانست واکسن های مؤثری علیه بســـیاری از بیمـــاریها تهیه کند ، ولی درباره مکانیسم این عمل اطلاعات اندکی در دست داشت .او عقیده داشت که ارگانیسم های موجود در واکسن ، مواد غذایی مورد نیاز برای رشدشان را از بدن گرفته و به این ترتیب از رشد عوامل بیماری زا جلوگیری می کند . در سال 1888 دانشمندی به نام ریچت [13]مشاهده کرد که اگر باکتری یا میکروبی را به حیوانی مثل خرگوش تزریق کنند موادی در سرم خرگوش به وجود می آید که خاصیت کشندگی باکتری را دارد . سپس در سال 1890 در برلین ، دانشمندی به نام امیل ون بهرینگ [14] به همراه کیتاساتو [15] نشان دادند که مصونیت ایجاد شده بوسیله واکـسیناسیون به علت حضور بعضی عوامل بخصوص در خون می باشد . آنها نام این عوامل را آنتی بادی نامیدند . چند سال بعد یک شیمیدان آلمانی به نام پارل ارلیش [16] ثابت کرد که آنتی بادی ها علاوه بر اینکه جانوران را در برابر فراورده های باکتریال محافظت می نمایند در برابر سم ها (توکسین ) های خارجی نیز حفظ می کنند . تقریبا در همان زمان یک دانشمند آلمانی دیگر بنام ریچارد پیفیفر [17] نشان داد که آنتی بادی ها می توانند که یک سوسپانسیون باکتریایی را مجتمع کنند (آگلو تیناسیون ) و بدین ترتیب سبب نابودی عامل مولد وبا در انسان (ویبریو کلرا )گردند . این پدیده که آنتی بادی ها می توانند یک سوسپانسیون باکتریال را مجتمع کنند توسط فردی بنام ویدال [18] برای تشخیص بیماریهای روده ای ناشی از باکتری سالمونلا و توسط فرد دیگری بنام رایت [19] برای تشخیص بیماری بروسلوز (تب مالت )بکار گرفته شد . در سال 1894 دانشمندی بنام امیل – رو [20] نشان داد که بیماران مبتلا به دیفتری را می توان با تزریق سرم است ایمن شده علیه دیفتری درمان کرد . این مسئله سبب ایجاد امیدواری نسبت به امکان درمان سایر بیماریها به این روش شد ولی متاسفانه هیچیک از موارد دیگر به اندازه درمان دیفتری مؤثر واقع نگشت . با وجود این نشان داده شد که سرم یک اسب ایمن شده علیه کزاز بوسیله واکسیناسیون را می توان برای ایمن سازی انسان نیز بکار برد و فرد گیرنده ، بمدت چند هفته نسبت به بیماری کزاز مقاوم خواهد شد . مطالعات بعدی در باره خواص آنتی بادی ها در سال 1893 نشان داد که حرارت دادن سرم حاوی آنتی بادی ها تا دمای 56ºC خاصیت میکروب کشی آنرا از بین می برد در حالیکه بر روی خاصیت تجمع باکتریها اثری ندارد . دانشمندان متوجه شدند که این جزء حساس به حرارت باعث خاصیت میکروب کشی می گردد و ماده ای سوای آنتی بادی می باشد . جولز بوردت [21] در ابتدا نام این مواد را آلکسین [22] نامیدند ولی این اجزاء امروزه به کمپلمان[23] یا مکمل موسوم است . اولین بحث و جدل مهم و عمده ای که در زمینه علم ایمنو لوژی رخ داد توسط یک دانشمند روس بنام مچنیکف[24] آغاز شد . او در سال 1845 در روسیه متولد شد و تحصیلات خود را در رشته جانور شناسی به پایان برد . وی در ابتدا در بی مهرگان و سپس در پستانداران نشان داد که سلول های مخصوص توانایی خوردن و بلع مواد خارجی را دارا هستند مچنیکف عقیده داشت که این سلول های بیگانه خوار یا فاگوسیتیک [25] دفاع عمده بدن را در برابر میکرو ارگانیسم های مهاجم تشکیل می دهند . همچنین او اعتقاد داشت که آنتی بادی ها در ایمنی بدن اهمیت چندانی ندارند . بیان این عقیده مباحثات فراوانی به دنبال داشت تا اینکه در سال 1903 فردی به نام آلمروت رایت[26] در انگلستان و دانشمند دیگری به نام ژوزف دنیس [27] در بلژیک نشان داد که آنتی بادی ها می توانند سطح باکتریها را پوشانده و سبب تسهیل عمل تخریب و بلع این ارگانیسم توسط سلول های فاگوسیتیک گردند. این عمل بنام خوشمزه سازی یا اپسونیزاسیون[28] نام گرفت و به این آنتی بادی ها اپسونین یا خوشمزه کننده گفتند . بدنبال این مسئله تقسیم بندی آنتی باددیها بر اساس عملی که انجام می دادند مرسوم شده و آنتی بادی هایی که سبب تجمع باکتریها و ذرات میکروبی می شدند (آگلو تینین )[29] ، آنتی بادی هایی که سبب رسوب باکتریها می گردیدند بنام رسوب دهنده یا (پرسی پیتین)[30] ،آنتی بادی هایی که سبب لیز گلبولهای قرمز می شدند همو لیزین [31]و بالاخره آنتی بادی هایی که سبب لیز باکتریها می گشتند (باکتریو لیزین) [32], نام گذاری کردند . اولین تئوری که در مورد چگونگی تولید آنتی بادی ها ارائه گردید مربوط به پال ارلیش بود و بنام تئوری زنجیره جانبی [33]معروف گردید . او معتقد بود که بر سطح سلول ها ،زنجیره های جانبی متعددی وجود دارد که به عنوان گیرنده مواد خارجی یا آنتی ژن ها عمل می کنند و این گیرنده برای حمل مواد غذایی به درون سلول ها به کار می رود وقتی که یک عامل خارجی ویا مواد سمی وارد بدن می شوند بسته به ساختمان شیمیایی آن ماده ممکن است که به جایگاههای ویژه از این زنجیره های جانبی متصل شوند و سلول در پاسخ به این عمل مقدار زیادی از همان زنجیره های جانبی را ساخته و به درون خون می ریزد که به عنوان آنتی بادی شناخته شود . این عقیده که نشان دهنده اختصاصی بودن پاسخ ایمنی است ، در حدود صد سال پیش عنوان گردید ولی در طول زمان و به دو صورت تصحیح شد . در وحله اول به صورت نظریه آموزشی [34] مطرح گردید که معتقد بود سلول های صلاحیت دار سیستم ایمنی و آنتی بادی ها بعد از معرفی آنتی ژن ، اختصاصی بودن خود را کسب می کنند ، بدین صورت که آنتی ژن ها شکل فضایی گیرنده های آنتی ژن را تغییر می دهد تا شناسایی انجام گیرد . نظریه دوم که اکنون تائید شده است بنام فرضیه انتخاب کلون [35] در ابتدا به وسیله نیل جرن [36]در سال 1955 و سپس بوسیله تالماج [37] و برنت [38] در سال 1957 عنوان شده و بر طبق این نظریه هر فرد دارای کلونهای لنفو سیتی فراوانی است ولی هر کلون از یک سلول پیش ساز واحد بوجود می آید و از این رو یک شاخص آنتی ژنی بخصوصی را خواهد شناخت و به آن پاسخ خواهد داد . یعنی کلونها ورد ه های مختلف سلولی قبل از برخورد با آنتی ژن و مستقل از آن ایجاد می شوند و در بدن حدود 1011-109 کلون لنفوسیتی مختلف وجود دارد . حال با ورود آنتی ژن ، یک کلون لنفوسیتی اختصاصی که قبل از ورود آن تشکیل شده است ،انتخاب شده و با اتصال آنتی ژن فعال می گردد و پاسخ ایمنی اختصاصی علیه آن آنتی ژن بخصوص شکل می گیرد .
تاریخچه علم ایمونولوژی از ابتدای قرن بیستم به بعد قدری پیچیده است و دانشمندان بسیاری توانسته اند از رازهای شگفت سیستم ایمنی بدن پرده بردارند ولی طرح کلی این پیشرفتها را می توان با در نظر گرفتن جوایز نوبلی که در طول این دوره به ایمونو لوژیست ها اهدا ء شده است ترسیم نمود .
- اولین جایزه نوبل در پزشکی به امیل ون بهرینگ در سال 1901 بخاطر کار بر روی آنتی توکسین ها به وی اهدا گردید
- در سال 1905 رابرت کخ [39] به خاطر مطالعه برروی بیماری سل و کشف واکسن توبرکولین و پدیده ازدیاد حساسیت جایزه نوبل دریافت کرد
- در سال 1908 پارل ار لیش و مچنیکوف به خاطر سالها تلاش در جهت ارائه نظریه های متعدد و توضیح ایمنی های سلولی و همورال مشترکاً جایزه نوبل دریافت کرد
- در سال 1913 چارلز ریچیت به خاطر کشف آنا فیلاکسی و تحقیق بر روی آلرژی جایزه نوبل را از آن خود ساخت
- در سال 1919 جولز بوردت به خاطر کشف سیستم کمپلمان و ایجاد تست ثبوت کمپلمان جایزه نوبل گرفت
- در سال 1928 نیکول [40] به خاطر تحقیقات ارزنده ای که بر روی بیماری تیفوس انجام داد موفق به دریافت جایزه گردید
- در سال 1930 کارل لند شتاینر[41] به خاطر تشریح گروهای خونی و آنتی ژن های موجود برروی سطح گلبولهای قرمز جایزه نوبل گرفت . البته این دانشمند بزرگ 25 سال در مورد هاپتن ها کار کرده و 167 مقاله دراین مورد منتشرنموده است .
- در سال 1960 دو دانشمند به نامهای پیتر مداوار[42] و مک فارلین بورنت[43] به خاطر مطالعه بر روی روشهای تشخیص مواد بیگانه توسط سیستم ایمنی و در نتیجه جلوگیری از ایجاد واکنش علیه بافت های خودی و تئوری انتخاب کلونی بطور مشترک جایزه نوبل دریافت کردند . این دو دانشمند برای اولین بار تحمل اکتسابی ایمونولوژیک را نیز بیان کردند.
- در سال 1972نیز دو دانشمند شیمیدان متخصص در زمینه پروتئین ها بنام رادنی پورتر [44]و جرالد ادلمن [45] به خاطر تشریح دقیق ساختمان شیمیایی مولکول های آنتی بادی شایسته در یافت جایزه نوبل شناخته شدند.
- در سال 1977روزالین یالو[46] به خاطر مطالعه بر روی روشهای رادیوایمونواسی [47] و ابداع آن موفق به در یافت جایزه نوبل گردید.
- در سال 1980 در فیزیو لوژی و پزشکی مشترکاً به سه ایمونولوژیست که گامهای مؤثری در راه پیشرفت علم ایمونوژنتیک برداشته بودند، جایزه نوبل اهدا گردید . جورج اسنل [48] با بررسی ژن های دفع پیوند ، جین داست [49] با ابداع روشهائی برای تشخیص آنتی ژن های موجود بر روی سلول های انسان و ایجاد سازگاری بهتر برای دهنده و گیرنده پیوند عضو تا احتمال دفع پیوند به حداقل ممکن برسد و باروژ بینسراف[50] با برسی نحوه توارث توانایی یک حیوان برای تولید آنتی بادی علیه یک آنتی ژن معین ، موفق به در یافت جایزه نوبل شدند.
- درسال1984 نیز جایزه نوبل مشترکا به سه نفر اهدا شد . نیلز جرن[51] به خاطر تئوری در ارتباط با اختصاصیت ، تکامل و چگونگی کنترل سیتم ایمنی و توصیف شبکه ایدیوتایپ و جورج کوهلر [52]و سزار میلشتین[53] به خاطر کشف پدیده های اصول تولیدآنتی بادی های مونوکلونال شایسته در یافت جایزه نوبل شدند.
- در سال 1987 دانشمند ژاپنی به نام تونگاوا [54] به خاطر کشف پدیده های ژنتیکی در تولید آنتی بادی های مختلف جایزه نوبل در یافت کرد.
البته دانشمندان بسیاری در زمینه های مختلف ایمونو لوژی تحقیقات وسیعی انجام داده که همگی موفق به در یافت جایزه نوبل شده اند. از این دانشمندان می توان به کومبس[55] اشاره کرد که در سال 1945 در کمبریج انگلستان به انجام تست آنتی گلبولین موفق گردید که امروزه بنام خود او تست کومبس معروف بوده و برای تعیین آنتی بادی های نا کامل یا ناقص بکار می رود. همچنین در سال 1942 دانشمندی به نام فلتون [56] نشان داد که اگر به موشی مقدار کمی پلی ساکاریدهای باکتری پنوموکوک تزریق شود ، یک نوع مصونیت برای حیوان ایجاد می شود و اگر مقدار تزریق زیاد باشد به عفونت منجر می شود . این پدیده به نام خود او "فنومن فلتون " نامیده شد . در سال 1953 دانشمندی بنام گرابار [57] به کشف آنتی بادی IgA موفق شد ودر سال 1962 میلر [58]در لندن به نقش واهمیت تیموس در ایمونولوژی پی برد . همچنین دانشمندان دیگری نیز کشفیات وتحقیقات مهمی انجام داده اند که برای جلوگیری از اطاله ی کلام از ذکر اسلامی آنها خودداری شده ولی در هریک از مباحث مربوطه تا حد امکان به معرفی آنان می پردازیم.
تعریف ایمنی شناسی:
تمامی جانوران باید درمقابل بیماری هایی که بوسیله ی میکروارگانیسم هایی مانند :باکتری ها ،ویروس ها ، قارچ ها وانگل ها ایجاد می گردند ازخود دفاع نمایند . برای حفظ و بقا و عمل طبیعی یک جاندار ، دفاع در برابر این ارگانیسم ها و نظایر آنها ضروری بوده و بنظر می رسد که عدم موفقیت در انجام این کار در عرض چند روز یا حداکثر چند هفته منجر به مرگ در اثر عفونت شدید می گردد . همچنین برای مقآبله با سرطان و انواع بد خیمی ها ، مانند بیماری های ویروسی لازم است که بدن در برابر سلول های غیر طبیعی مانند سلول های سرطانی شده و سلول های آلوده به ویروس از خود دفاع نماید .
ایمونولوژی علمی است که در بر گیرنده ی مکانیسم های دفاعی بدن بوده و روش های تحریک این سیستم های دفاعی را بمنظور کاهش خطر بیماری ها به ما معرفی می نماید . ایمونولوژی علمی تجربی است که به تفسیر پدیده های ایمونولوژیک بر پایه ی مشاهدات تجربی و نتایج حاصل از آن می پردازد .رشد و تکامل علم ایمونولوژی به صورت یک روش تجربی مرهون توانایی ما در فراهم آوردن شرایط کنترل شده برای بررسی اعمال سیستم ایمنی می باشد . اساسا ایمونولوژی در رابطه با شناخت این مفهوم است که چگونه بدن خود را از غیر خودی می شناسد و سایر تعاریف توضیح این اصل کلی است چنانکه لویس توماس دانشمند بزرگ در کتاب خود در مورد همزیستی و زندگی انگلی به شرح نیروهایی پرداخته است که اگر مکانیسم های پاسخ ایمنی که خودی را از غیرخودی تمیز می دهد نمی بود تمامی مواد زنده را به صورت توپ عظیمی از پروتوپلاسم در می آورد . مبدا این مکانیسم های شناسایی به تاریخ تکاملی بر می گردد و در حقیقت بسیاری از آنها از شاخص هایی نشات گرفته اند که سلول ها را قادر می سازند یکدیگر را شناخته و همزیستی مناسبی را پایه گذاری کنند .برای مثال کلونی های اسفنج که قرابت ژنتیکی دارند ، اگر در کنار یکدیگر قرار داده شوند تمایل دارند در جهت همدیگر رشد کرده و به صورت یک کلونی بزرگ در هم می آمیزند . به هر حال کلونی هایی که قرابت ژنتیکی ندارند به گونه دیگری عمل کرده و سلول هایی را که به یکدیگر نزدیک می شوند ومنطقه دافعه بین کلونی ها را باقی می گذارند .در سلسله های گیاهی نیز انواع مشابهی از شناسایی وجود دارد و مثلا در گونه های خود تلقیح دانه گرده که بر روی کلاله گلی که قرابت ژنتیکی دارد فرود می آید و لوله گرده را از طریق خامه جهت بارور نمودن به طرف تخمدان می فرستند ، اما دانه ی گرده ای که قرابت ژنتیکی ندارد جوانه نخواهد زد ویا اگر لوله گرده تشکیل شود درون خامه از بین خواهد رفت . در گونه های دیگر که گرده افشانی متقاطع یا دگر تلقیحی دارند عکس این پدیده روی داده و دانه های گرده خودی از بین می روند در حالی که دانه های غیر خودی جوانه زده و تخمک را بارور می سازند.
* ماهیت این مکانیسم های شناسایی شامل مولکول های سطحی است که قادرند به طور اختصاصی به ملکول های سطح سلول های دیگر اتصال یابند و این روش شناسائی ساده در طول زمان به سیستم پیچیده ایمنی تکامل یافته که اساس آن نیز توانایی های مولکول های پروتئینی است که قادر است به طور اختصاصی ساختمان های خاص را بر مولکول های دیگر شناسایی کرده و با آن پیوند یابد. این چنین شناسایی مو لکولی اساس افتراق خودی با غیر خودی توسط پاسخ های ایمنی است.
در طی سال های گذشته درک ما از سیستم ایمنی بطور فراینده ای گسترش یافته است . پیشرفت در روش های کشت سلولی،نو ترکیبی DNA و بیو شیمی پروتئین ها ، ایمنولوژی را از یک علم توصیفی به علمی تبدیل نموده که بر پایه آن می توان پدیده های گوناگون ایمنی را به صورت مرتبط با یکدیگر ارزیابی کرده و سپس براساس روندهای بیوشیمیایی و ساختاری به طور دقیق تفسیر نمود .
ایمنی طبیعی (ذاتی یا فطری )
در یک نگاه کلی می توان پاسخ ایمنی را به دو قسمت تقسیم کرد
*در افراد سالم مکانیسم های مختلفی مانند سدهای فیزیکی ( پوست وغشاهای مخاطی)، سلول های بیگانه خوار [59]در خون و بافت ها ،(ماکروفاژها ، نوتروفیلها و سلول های کشنده طبیعیNK-Cell ) ، واسطه های شیمیایی محلولی چون (سیتوکینهای حاصل از ماکروفاژ مانند اینترفرون آلفا و بتا و فاکتور نکروز دهنده تومور (TNF) و مواد دیگر بدن را از هجوم میکروب ها و عوامل مهاجم حفظ می کنند . همه این فاکتورها در پاسخ بر ضد عوامل مهاجم محیطی شرکت می کنند و اکثر آنها قبل از ورود میکروب ها یا ماکرومولکول ها در بدن وجود دارند ، این عوامل تفاوتی بین عوامل خارجی نمی گذارند و معمولا قدرت آنها در طی برخوردهای متوالی افزایش نمی یابند به همین خاطر این مکانیسم های دفاعی را اجزای ایمنی طبیعی [60] ذاتی [61] یا فطری[62] می نامند . سدهای آناتومیکی چون آنزیم های موجود در بزاق (لیزوزیم) ، اسیدیته قوی معده و املاح صفراوی ،حرکات دودی روده ، ترشحات مخاطی ، مکانیسم ها و رفلکس های عصبی چون سرفه و عطسه که سبب بیرون راندن مواد خارجی می گردند و دهها عامل دیگر همگی جزء سیتم ایمنی ذاتی هستند .
* دومین عامل در سیستم ایمنی ذاتی وجود سلول های بخصوصی است که سبب بیگانه خواری و فاگوسیتوز آنتی ژن ها و عوامل خارجی می گردند این سلول هاتحت عنوان سلول های بیگانه خوار چند هسته ای در بدن وجود دارند ، فاگوسیت های تک هسته ای از منوسیت های خون مشتق شده و در هر بافتی نام خاصی دارند مثلا ماکرو فاژهایی که در آلول های ریوی هستند آلوئولار[63] نام داشته که اولین سد دفاعی در برابر آنتی ژن های وارد شده از طریق استنشاق مانند باکتری مولد سل و... می باشند ، ماکرو فاژهای کبدی تحت عنوان کوپفر[64] ، در مفاصل بنام سینووئید [65]، در مغز بنام ماکروگلیا [66] در کلیه بنام مزانشیال [67]، در بافت همبند بنام هیستوسیت[68]، در خود مغز استخوان بنام استئوکلاست[69] و ...نامیده می شوند و در هر اندامی به دلیل معماری خاص آن بافت یا ارگان تغییر شکل پیدا کرده و شکل خاصی به خود می گیرند ،سلول های بیگانه خوار (فاگوسیتیک ) چند هسته ای نیز بنام پلی مورفونوکلئار[70] دارای انواع خاصی هستند ، نوتروفیها ،ائوزینوفیلها، بازوفیلها ،سلول های چند هسته ای هستند که دوتای اول وظیفه فاگوسیتوز دارند . تعداد منوسیت ها در خون محیطی کم در حدود (5-1) درصد است اما مقدار نوتروفیلها بسیار زیاد و در حدود 75% از سلول های لکوسیت خون محیطی را تشکیل می دهند دسته سوم سلول های در گیر در ایمنی ذاتی سلول های کشنده طبیعی[71] یا سلول های NK هستند این ها از نظر ساختمانی در دسته لنفوسیت ها بوده ولی علیه سلول های آلوده به ویروس و سلول های سرطانی به صورت غیر اختصاصی فعالیت می کنند. غیر از سلول های درگیر یکسری مواد محلول نیز مانند اینترفرون ها (الفا وبتا) و فاکتور نکروز دهنده تومور (TNF) [72]که عمدتا از ماکروفاژها تولید می شوند فعالیت های ضد ویروسی وضد سلول های سرطانی دارند که جزء سیستم ایمنی ذاتی محسوب می گردند . در ایمنی ذاتی نوع و ماهیت آنتی ژن سبب تعیین نوع پاسخ نمی شود و همچنین پس از برخورد سیستم ایمنی ذاتی با یک عامل خارجی خاطره ای در آن تشکیل نمی گردد ، بدین لحاظ دومین نوع سیستم ایمنی برای رفع نقائص فوق بوجود آمده که در این ساخت و کار پاسخ ایمنی علیه آنتی ژن ها و ماکرو مولکول های مختلف بسیار اختصاصی است و در برخورد های مکرر با یک آنتی ژن توانایی و دامنه پاسخ نیز افزایش می یابد این نوع از مصونیت را ایمنی اکتسابی [73] یا اختصاصی [74]می گویند ، این سیتم ایمنی بسیاری از مکانیسم های موثر در ایمنی ذاتی برای حذف عوامل مهاجم بیگانه را حفظ کرده و دوویژگی مهم دیگر به آن افزوده می شود ، اول آنکه سیتم ایمنی اختصاصی برخورد با یک میکروب یا آنتی ژن خارجی را به خاطر می سپارد و در برخوردهای بعدی با آن تحریک قویتر و موثرتری ایجاد می کند که این پدیده را خاطره ایمنولوژیک [75]می نامند و اساس خاصیت حفاظتی و واکسیناسیون در برابر بیماریهای عفونی است . خاصیت دوم اینکه پاسخ های ایمنی اختصاصی باعث تقویت قدرت اجزای ایمنی ذاتی می شود تا بهتر بتواند آنتی ژن های بیگانه را از بین ببرد . عوامل موثر در ایمنی اختصاصی سلول هایی بنام لنفوسیت و فراورده های ترشحی آنها مانند سیتوکین ها و آنتی بادی ها است
انواع ایمنی اختصاصی :
الف) ایمنی فعال و غیر فعال :
به هنگام برخورد فرد با یک آنتی ژن بیگانه پاسخ های ایمنی اختصاصی فعال می گردند به نوعی که در طی این روند مصونیت یا ایمنی بوجود می آید این نوع از ایمنی را فعال [76] می نامند ، زیرا سیستم ایمنی فرد در پاسخ به آنتی ژن نقش فعالی داشته است اما می توان این ایمنی را با گرفتن سلول ها یا سرم از فرد یا حیوانی که به صورت اختصاصی تحریک و ایمونیزه شده و به فرد دیگری منتقل نمود . در چنین شرایطی فرد گیرنده بدون اینکه با آنتی ژن برخورد داشته باشد به آن آنتی ژن خاص مقاوم یا ایمن خواهد شد . به این نوع از مصونیت ایمنی غیر فعال [77] می گویند - روند انتقال سلول ها یا محصولات ایمنی را از فردی به فرد دیگر انتقال سازگار [78] نامیده می شود.
ب) ایمنی سلولی و هومورال:
ایمنی اختصاصی را براساس نوع اجزای موثر در ایجاد پاسخ به دو گروه تقسیم می کنند .
در ایمنی هومورال مولکول هایی در خون بنام آنتی بادی مسئول ایجاد این نوع از ایمنی است . آنتی بادی ها به طور اختصاصی آنتی ژن ها را شناسائی کرده و حذف می کنند و می توان بدون انتقال اجزای سلولی و فقط با انتقال آنتی بادی توسط پلاسما یا سرم این ایمنی را از فردی به فرد دیگر انتقال داد ، آنتی بادی ها توسط سلول هایی به نام پلاسما سل که از فعال شدن و تمایز سلول های لنفوسیتی B ایجاد شده اند تو.لید می گردند ، همانطور که در مقدمه گفته شد برای نخستین بار توسط بهرینگ و کیتاساتو نشان داده شد که اگر سرم حیوانات بهبود یافته از عفونت دیفتری را به به حیوانات غیر ایمن منتقل می نمائیم این حیوانات نیز به طور اختصاصی به دیفتری مقاوم خواهند شد ، آنها این جزء فعال سرم را بنام ضد سم یا آنتی توکسین [79] نامیدند زیرا سم باکتری را خنثی می کند . بعد از آن دانشمندان دیگری نشان دادند که علاوه بر سم باکتریها سایر مواد میکروبی نیز سبب تحریک ایمنی هومورال و ترشح آنتی بادی می شوند تا پس از سالها واژه آنتی ژن برای مواد خارجی که سیستم ایمنی را تحریک و وادار به فعالیت می کنند و واژه آنتی بادی برای پروتئین هایی که علیه آنتی ژن ها ایجاد می شوند بوجود آمد ،در این نوع ایمنی سلول های B که دارای گیرنده های آنتی ژن که همان آنتی بادی ها در سطح سلول های B هستند می توانند آنتی ژن های مختلف را شناسایی کرده و پس از فعال شدن و تبدیل به پلاسماسل مقادیر زیادی آنتی بادی ساخته و به درون خون ترشح کنند .
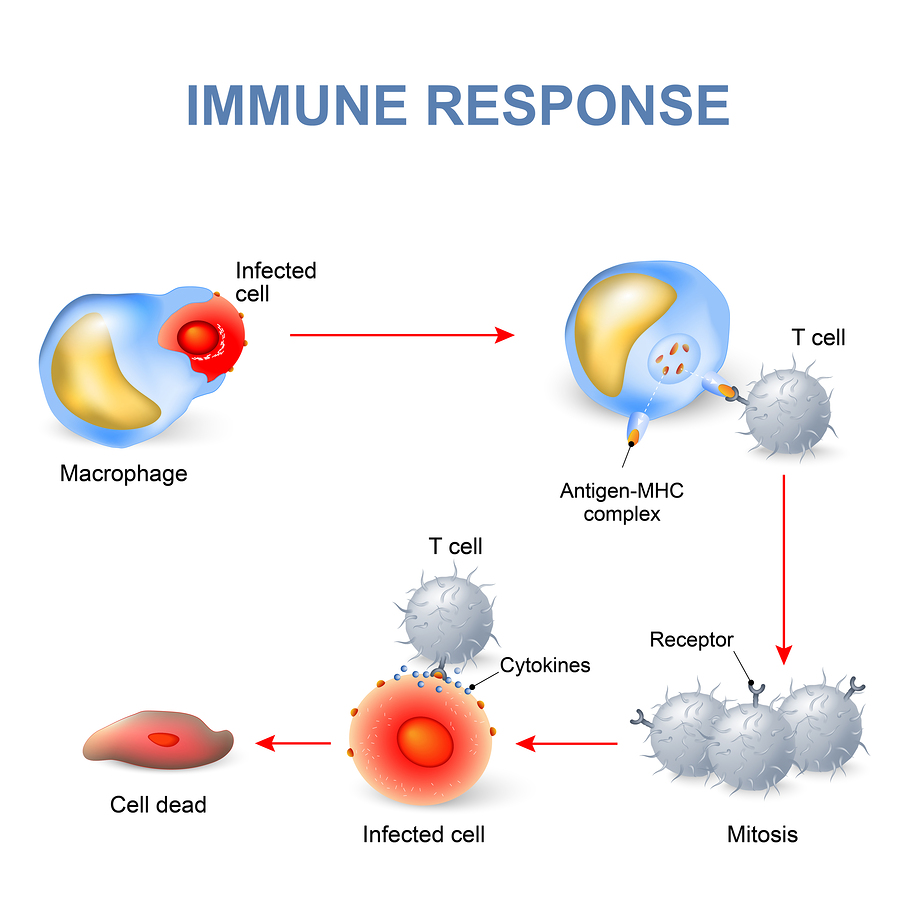
تئوری ایمنی سلولی برای اولین بار توسط مچنیکوف و بدنبال مشاهده بیگانه خواری در سلول های فاگوسیت کننده ارائه شد و همانطور که دیدیم فاگوسیت ها اجزای اصلی ایمتی ذاتی هستند . حال ایمنی سلولی [80]یا ایمنی وابسته به سلول که تحت عنوان [81] (CMI) نامیده می شود یک نوع ایمنی اختصاصی یا اکتسابی است که در آن سلول های T و فرآورده های ترشحی آنها مطرح است . معمولا دو نوع سلول T داریم . یک نوع تحت عنوان سلول T کمک کننده (Helper) Th یا القا دهنده ( Inducer) Ti نامیده می شود و دیگری بنام T سلول کش ( Cytotoxic) Tc معروفند ، سلول های T برخلاف سلول های B نمی توانند به طور مستقیم توسط گیرنده آنتی ژن خود که [82] (TCR) نامیده می شوند آنتی ژن هایی را شناسایی کنند و برای این کار و ایجاد پاسخ بایستی حتما آنتی ژن ها را در مجاورت مولکول های اصلی سازگاری نسجی که بنام [83] MHC نامیده می شوند شناسایی کنند . گفتیم که فاگوسیت های بیگانه خوار آنتی ژن ها را به طریق مختلف به درون خود کشیده و بلع و هضم می کنند این سلول های تک هسته ای ( ماکروفاژها، سلول های دندریتیک) می توانند شاخص های آنتی ژنیک یا (اپی توپ های )[84] مربوط به عامل خارجی را پس از پردازش[85] در سطح خود بروز دهند ، این شاخص ها ی آنتی ژنیک توسط مولکول های سازگاری نسجی (MHC )که خود دو کلاس مختلف تقسیم می شوند در سطح اول به سلول های T عرضه می گردند ، عرضه آنتی ژن توسط سلول های بیگانه خوار به سلول های T معرفی [86] گفته شده و این سلول ها را سلول های عرضه کننده آنتی ژن [87](APC) می نامند. سلول های T کمک کننده [88] شاخص های آنتی ژنیک را در مجاورت مولکول های کلاس دو سازگاری سنجی MHC-II)) و سلول های T سلول کش [89]آنتی ژن ها را در مجاورت مولکول های کلاس یک سازگاری سنجی (MHC-I) شناسایی می کنند . پس از شناسایی آنتی ژن توسط سلول های T ، سلول های Th فعال شده و شروع به ساخت مواد محلولی بنام سیتوکین کرده که شامل انواع اینترلوکین [90] و اینترفرون گاما و... شده و سبب فعالیت کل سیستم ایمنی و ماکرو فاژها ، سلول های B و دیگر سلول های T می گردند . مهمترین اینترلوکین ، اینترلوکین دو (IL-2) بوده که در بحث سیتوکین ها به تفصیل مورد بررسی قرار می گیرند ، سلول های TC نیز پس از شناسایی آنتی ژن فعال شده و هم فاکتورهای ترشحی تولید می کنند و هم به طور مستقیم سبب از بین بردن سلول های آلوده به ویروس و باکتری های داخل سلولی و سلول های سرطانی می گردند.
ایمنی هومورال مهمترین مکانیسم دفاعی در برابر میکروب های خارج سلولی و ترشحات سمی آنها می باشد زیرا آنتی بادی ها می توانند به آنها متصل شده و آنها را از بین ببرند ولی ایمنی سلولی مهمترین مکانیسم دفاعی بر ضد میکروب های داخل سلولی مثل ویروس ها و باکتری های داخل سلولی و همچنین مبارزه علیه کانون های سرطانی و بدخیمی های مختلف است.
* ارتباط بین قسمت های مختلف ایمنی ذاتی و ایمنی اختصاصی سبب کار آیی بهتر سیستم ایمنی بدن می گردد: مثلا به هنگام ورود یک باکتری در خون موادی فعال در خون رها می شوند وباعث می گردند که بیگانه خوارها به محلی که باکتری وارد شده است هجوم بیاورند . این عمل را کیموتاکسی [91] گفته وعواملی که سبب جذب سلول های بیگانه خوار می گردند کموتاکتیک [92] می نامند ، عواملی مانند اجزای سیستم کمپلمان یا مکمل ضمن اینکه می توانند مستقیما به باکتری ها متصل شده و سبب نابودی و لیز باکتری ها گردند ، می توانند به عنوان اپسونین سبب خوشمزه سازی [93] باکتریها جهت بلع توسط فاگوسیت ها گردند ، همچنین اجزای مختلفی از سیستم کمپلمان مانند C3aوC5a نیز می توانند سبب کیموتاکسی گردند ، برخی از پروتئین های فاکتور های مترشحه توسط خود بافت های آسیب دیده یا بیگانه خواری چند هسته ای نیز سبب کیمو تاکسی می گردند . بعد از جذب سلول های بیگانه خوار به محل آسیب دیده یا عفونی در گیری و بیگانه خواری شروع می شود و این سلول ها با ایجاد پاهای کاذب و تشکیل واکوئل ذرات خارجی را می بلعند و سپس آنزیم هایی که در لیزوزیم این سلول ها وجود دارد به فاگوزوم های محتوای آنتی ژن متصل و با تشکیل فاگولیزوزیم سبب هضم عوامل باکتریایی و خارجی می گردند ، همانطور که دیدیم بر روی سطح این بیگانه خوارها گیرنده هایی برای ناحیه ثابت آنتی بادی [94] (FC) وجود داشته که آنتی بادی ها نیز پس از اتصال به آنتی ژن می توانند به بلع مواد خارجی کمک کنند ، حال سلول های بیگانه خوار علاوه بر بلع و هضم مواد خارجی می توانند قسمت های مهم و شاخص های آنتی ژنیک عوامل خارجی را در سیتوپلاسم خود پردازش کرده و توسط مولکول های MHC به سلول های صلاحیت دار سیستم ایمنی عرضه کنند و بدین ترتیب یک سلول مهم در ایمنی ذاتی سبب فعال شدن سیستم ایمنی اختصاصی سلولی شده و سلول های Thو Tc فعال گردند.
ویژگیهای برجسته پاسخ های ایمنی اختصاصی:
* 1)اختصاصی بودن [95] :
پاسخ های ایمنی اختصاصی برای آنتی ژن ها ی میکروبی و حتی برای اجزای مختلف یک پروتئین ، پلی ساکارید یا ... اختصاصی است ، قسمتی از آنتی ژن را که بطور اختصاصی لنفوسیت ها شناسایی می کنند شاخص [96] یا اپی توپ [97] می نامند و دلیل اختصاصی بودن پاسخ وجود گیرنده های غشایی لنفوسیت های Tو B است که می توانند آنتی ژن های مختلف را به دقت شناسایی کنند.
*2)تنوع [98] :
همه ی دسته های لنفوسیتی اختصاصی برای آنتی ژن های گوناگون در یک فرد را اصطلاحاً گنجینه ی لنفوسیتی [99]می نامند که بسیار متنوع و عظیم است و در سیستم ایمنی پستانداران حداقل 11 10-9 10 شاخص آنتی ژن را شناسایی می کند ، این تنوع گسترده نتیجه تغییر پذیری جایگاه های اتصال به آنتی ژن در گیرنده لنفوسیت ها است .
*3) خاطره [100]:
در سیستم ایمنی اختصاصی (هومورال یا سلولی )وقتی یک عامل خارجی یا باکتری در معرض سلول های صلاحیت دار Bیا T قرار می گیرد و علیه آن پاسخ ایمنی اختصاصی ایجاد می شود یک خاطره از خود در حافظه سیستم ایمنی اختصاصی بجای می گذارد ، هنگامی که یک فرد برای اولین بار در معرض یک عامل خارجی قرار می گیرد چند روز طول می کشد تا سیستم ایمنی آن را شناسایی کند و به آن پاسخ دهد ، این مدت به نام دوره کمون[101] یا فاز استراحت [102] نامیده می شود. مدت زمان این دوره معمولا 3-7 روز است و بستگی به روش مورد استفاده برای تزریق آنتی ژن دارد ، پس از این مدت سطح آنتی بادی ضد عامل خارجی به سرعت افزایش می یابد و 10 الی 14 روز پس از تزریق آنتی ژن به حداکثر می رسد . سپس مقدار این آنتی بادی ها به سرعت کاهش یافته و پس از چند هفته بکلی ناپدید می شود ، این مراحل سه گانه پاسخ ایمنی (دوره کمون اولیه ، افزایش آنتی بادی ، کاهش سریع) را پاسخ ایمنی اولیه [103] می نامند ، اگر مدتی پس از تزریق اول یک تزریق مجدد از همان عامل خارجی صورت گیرد دیده می شود که طول دوره کمون کوتاه تر شده و در حدود 2-3 روز می باشد ، پس از آن آنتی بادی ها در خون ظاهر شده و به سرعت افزایش می یابد. طوری که چند برابر پاسخ اولیه می باشد و پس از این مقدار آنتی بادی به آرامی رو به کاهش می یابد این پاسخ را پاسخ ثانویه [104] می نامند ، با توجه به مثال فوق می توان نتیجه گرفت که برخورد سیستم ایمنی با یک آنتی ژن بیگانه توانایی آن را در پاسخ مجدد به همان آنتی ژن افزایش یافته و پاسخ ثانویه معمولا سریعتر ، قویتر و و از نظر کمی بیشتر از پاسخ اولیه خواهد بود ، این ویژگی ایمنی اختصاصی خاطره ایمونوژیک [105] نام دارد .
*4) تعدیل خود به خود[106] :
تمام پاسخ های طبیعی سیستم ایمنی بعد از تحریک آنتی ژن با گذشت زمان رو به کاستی می رود ، مهمترین دلیل حذف آنتی ژن در طی روند پاسخ و در نتیجه حذف تحریک آنتی ژن برای فعالیت مداوم لنفوسیت ها است ، همچنین لنفوسیت ها بعد از فعالیت یا به سلول هایی با نیمه عمر کوتاه تبدیل می شوند و یا به سلول های خاطره ای و در مرحله سوم آنتی ژن ها و پاسخ های ایمنی آنها مکانیسم های فیدبک یا خود تنظیمی را فعال می کنند که فعالیت اصلی آنها تنظیم پس نورد و یا برگردانیدن سیستم ایمنی به حالات اولیه است ضمن اینکه سلول های موسوم به T سرکوب کننده [107](Ts) یا فرو نشاننده با مکانیسم های متفاوتی مانند تولید سیتوکین های باز دارنده یا حذف عوامل ضروری برای رشد و تمایز سایر سلول ها ، سبب تعدیل فعالیت سیستم ایمنی می شوند.
*5) تشخیص خود از غیر خود [108] :
برجسته ترین ویژگی سیستم ایمنی همین ویژگی است زیرا گر چه لنفوسیت های هر فرد می تواند آنتی ژن های بیگانه بسیاری را شناسایی کرده و به آنها پاسخ دهند اما به طور طبیعی به مواد آنتی ژنیک خودی پاسخی نمی دهند. بی پاسخی ایمونولوژیک را تحمل یا تولرانس [109] می گویند. تحمل یک روند اکتسابی و آموزشی است زیرا لنفوسیت ها در گذر از مراحل خاص رشد خود اگر با آنتی ژن برخورد نمایند دچار مرگ سلولی خواهند شد ، لنفوسیت هایی که آنتی ژن های خودی را می شناسند در مرحله ای با آنتی ژن برخورد می کنند که هنوز از نظر عملکرد نارس هستند و بنابراین از رسیدن به مراحل بعدی رشد و کسب توانایی پاسخ باز می مانند ، حال اگر روندهای القا و حفظ تحمل به آنتی ژن های خودی مختل شود پاسخ ایمنی بر ضد آنتی ژن های خودی بوجود می آید و سبب ایجاد بیماری خود ایمنی[110] می گردد.
مراحل پاسخ ایمنی
ا)مرحله شناسایی [111]:
این مرحله اتصال یک عامل خارجی بیگانه یا آنتی ژن به گیرنده های اختصاصی در لنفوسیت های بالغ است. در سطح سلول B گیرنده اختصاصی آنتی ژن یا [112] BCR مولکول های آنتی بادی هستند که به پروتئین ها ، پلی ساکارید و لیپیدهای بیگانه محلول در گردش متصل می شوند ، گیرنده آنتی ژن در سطح سلول Tنیز [113](TCR) است که می تواند ردیف های کوتاهی از مولکول های پروتئینی را شناسایی کند و این شناسایی شاخص های آنتی ژنیک ، فقط در مجاورت مولکول های سازگاری نسجی یا(MHC) صورت می گیرد.
2 ) مرحله فعال شدن [114] :
این مرحله بعد از شناسایی آنتی ژن صورت گرفته و لازمه فعال شدن لنفوسیت ها فراهم شدن دو سیگنال متفاوت است . اولین پیام ، آنتی ژن بوده و پیام دوم فرآورده های میکروبی یا ترکیباتی از پاسخ های ایمنی ذاتی در برابر آنتی ژن است . این پدیده را فرضیه دو سیگنالی فعال شدن لنفوسیت می نامند . وجود آنتی ژن که پیام اول است ضرورت تضمین کنندة اختصاصی بودن پاسخ است و وجود محرک های اضافی که پیام دوم محسوب می شود باعث می گردد که در پاسخ های ایمنی در صورت نیاز القا شوند ( مثلاً در برابر میکروب ها و مواد مضر ) و در برابر مواد بی ضرر مثل آنتی ژن های خودی پاسخی روی ندهد .
فعال شدن لنفوسیت ها در دو مرحله اتفاق می افتد :
در مرحله اول لنفوسیت ها تکثیر یافته و کلونهای سلولی اختصاصی علیه آنتی ژن افزایش پیدا کرده و در مرحله بعداین سلول ها تمایز پیدا کرده و تبدیل به سلول های عملیاتی می شوند تا بتوانند آنتی ژن های بیگانه را حذف کنند . لنفوسیت های B به سلول های ترشح کننده آنتی بادی (پلاسماسل) تبدیل می شوند و سلول های t برحسب نوع ، فعالیت مشخصی نشان می دهند . سلول های Th که مارکرCD4 معرفه شناسایی آنهاست فعال شده و شروع به ساخت و تولید سیتو کینها و اینتر لوکین های مختلف جهت فعال کردن کل سیستم ایمنی می کنند و سلول های TC که مارکر CD8 معرفه آنهاست فعال شده تامیکروب ها و ویروسهای داخل سلولی را حذف و با سلول های سرطانی مقآبله نمایند ، عموماً لنفوسیت ها برای فعال شدن به دو پیام [115] نیاز دارند پیام اول از طرف آنتی ژن و پیام دوم از طریق سلول هایی بنام سلول های یاور [116]یا سلول های کمک ایمنی [117] ایجاد می گردند . این سلول ها و نوع پیام برای سلول های TوB مختلف است که در قسمت مربوطه توضیح داده خواهد شد .
3) مرحله عملیاتی [118]:
در این مرحله لنفوسیت های فعال اعمالی را بروز می دهند که منجر به حذف و نابودی آنتی ژن بیگانه خواهد شد ، در این مرحله سلول ها را به نام سلول های عملیاتی[119] می گویند ، آنتی بادی با اتصال به آنتی ژن در عمل بیگانه خواری تسهیل و تسریع انجام داده و همچنین سبب فعال شدن بیولوژیک کمپلمان می گردد که این عمل به نوبه خود سبب تخریب میکروب ها و سهولت فاگوسیتوز می گردد ، بعضی از آنتی بادی ها نیز سبب تحریک فاگوسیت ها و آزاد شدن واسطه های شیمیایی آنها برای مبارزه با میکروب ها می شوند ، لنفوسیت های Th نیز در این فاز با ترشح سیتوکین ها هم فعالیت فاگوسیتوز را تقویت کرده و هم در پاسخ های التهابی شرکت می کنند ، لنفوسیت های TC نیز به طور مستقیم علیه سلول های آلوده به ویروس یا باکتری های داخلی یا سلول های سرطانی وارد عمل شده و با ترشح مواد سمی مانند پرفورین و گرانزیم (GrB)B مقدمات نابودی و انهدام این سلول ها را فراهم می کنند .
هومئوستاز ( افول پاسخ های ایمنی ) :
سیستم ایمنی در انتهای پاسخ ایمنی به حالت عادی برمی گردد که عمدتاً ناشی از مرگ نوادگان لنفوسیت های تحریک شده با آنتی ژن در اثر آپوپتوز[120] است . آپوپتوز نوعی مرگ سلولی برنامه ریزی شده و فیزیولوژیک است که طی آن هستة سلول متراکم و قطعه قطعه شده و حباب ها و وزیکول هائی در غشاء پلاسمایی پدیدار می شوند . این فرآیند با نکروز متفاوت است زیرا نکروز نوعی مرگ سلولی است که طی آن غشاهای هسته ای و پلاسمایی پاره شده و محتویات سلولی غالباً بیرون می ریزند و سبب القا واکنش التهابی موضعی می گردد . بیشتر لنفوسیت های تحریک شده با آنتی ژن متحمل آپوپتوز می شوند . شاید به این دلیل که بقاء لنفوسیت ها وابسته به آنتی ژن و فاکتورهای رشد تولید شده توسط آنتی ژن است و با حذف آنتی ژن توسط پاسخ های ایمنی ، لنفوسیت ها از محرک های ضروری برای ادامه حیات محروم می گردند .
[1] . Immune System
[2] . Immune response
[3] . Thucydides
[4] . Mary Worthley Montagu
[5] . Variolation
[6] . Bengamin jesty
[7] . Edward Genner
[8] . Fracastoro
[9] . Sara nelmes
[10] . Vaccination
[11] . luis Pasteur
[12] . Charles Chamberland
[13] . Rechet
[14] . EmIL Von Behring
[15] . Kitasato
[16] . Paul –Erlich
[17] . Richard Pfeiffer
[18] . Widal
[19] . Wright
[20] . EmIL Roux
[21] . Jules bordet
[22] . Alexin
[23] . Complement
[24] . Metchnikoff
[25] . Phagocytic Cells
[26] . Almroth Wright
[27] . Josef Denys
[28] . Opsonization
[29] .Agglutinin
[30] . Precipitin
[31] . Hemolysin
[32] . Bacterio lysine
[33] . Side Chain Theory
[34] . Instructional Theory
[35] . Clonal Selection Theory
[36] . NILes Jerne
[37] . Talmadge
[38] . Burnet
[39] . Robert koch
[40] . Nicolle
[41] . Karl- Landsteiner
[42] . Peter Modawar
[43] . Mac Farlane Burnet
[44] . Rodany Porter
[45] . Gerald Edelman
[46] . Rosalyn Yalow
[47] . RIA
[48] . George Snell
[49] . Jean Dausset
[50] . BarujBenecereef
[51] . NILes Jerne
[52] . Georges Kohler
[53] . Cosar MILstein
[54] . Tongawa
[55] . Coombs
[56] . Felton
[57] . Grabar
[58] . mILler
[59] . Phagocytes
[60] . Natural
[61] . Innate
[62] . Native
[63] . Alveolar Macrophge
[64] . Kupffer Cells
[65] . Synovid Cells
[66] . Macroglia Cells
[67] . Mesangial Cells
[68] . Histocyte
[69] . Osteoclaste
[70] . Polymorphonuclear Cells
[71] . Natural KILler cells
[72] . Tumor Necrosis Factor
[73] . Acquired
[74] . Specific
[75] . Immunological Memory
[76] . Active
[77] . Passive
[78] . Adaptive Transfer
[79] . Antitoxin
[80] . Cellular Immunity
[81] . Cell Mediated Immunity
[82] . T- Cell-Receptor
[83] . Major histocompatibILity Complex
[84] . Epitope
[85] . Proccessing
[86] . Presentation
[87] . Antigen Presenting Cells
[88] . T-Helper
[89] . T- Cytotoxic
[90] . Interleukines
[91] . Chemotaxis
[92] . Chemotactic
[93] . Opsonization
[94] . Fragment Cristalization
[95] . Specificty
[96] . Determinant
[97] . Epitope
[98] . Diversity
[99] . Iymphocyte Repertoire
[100] . Memory
[101] . Incubation Period
[102] . Lag Phase
[103] . Primary Response
[104] . Secondoray Response
[105] . Immunological Memory
[106] . Self Limitation
[107] . T-Suppressor
[108] . Self Non Self Discrimination
[109] . Tolerance
[110] . Autoimmune
[111] . Cognitive Phase
[112] . B-Cell Receptor
[113] . T-Cell Receptor
[114] . Activation Phase
[115] . Signal
[116] . Helper cells
[117] . Accessory cells
[118] . Effector Phase
[119] . Effector Cells
[120] . Apoptosis
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
مطالب تصادفی:
- سمینار چیست؟|توضیح کامل |بررسی تفاوت همایش، کنفرانس، سمینار، کنگره، فراخوان، گردهمایی، میتینگ، جشنواره، کنوانسیون و کارگاه
- پایاننامه چیست؟| مراحل نوشتن پایان نامه و شرح کامل آن| تخصصی
- آموزش پروپوزال نویسی برای پایان نامه و رساله دکتری | تخصصی | انجام پروپوزال
- بهینهسازی تولید | طراحی آزمایشها با روش متدولوژی سطح پاسخ (RSM)
- رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
- آموزش قدم به قدم طراحی ازمایش (RSM) | با نرم افزار دیزاین اکسپرت +نحوه ارائه در مقالات علمی و پایان نامه ها
- رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
- طراحی آزمایش چیست؟ | آموزش کلیات به همراه توضیحات کامل هر مرحله
- آموزش RSM| تحلیل نمودارهای آماری در روش سطح پاسخ | نرم افزار دیزاین اکسپرت
- فیلم آموزشی کار با نرم افزار آنالیز تصاویر Image J